
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 5. «Растворы. Концентрация растворов»Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
5.1 Содержание программы Понятие дисперсных систем и растворов. Растворимость веществ. Физико-химическая теория растворов. Сольваты, гидраты. Способы выражения состава растворов. Уровень теоретической и практической подготовки Студент должен знать классификацию дисперсных систем, усвоить понятия «сольватация» и «гидратация», основные способы выражения количественного состава растворов. Студент должен уметь выполнять расчеты: навесок (объемов) для получения раствора заданной концентрации или заданного объема; концентраций по известному количеству компонентов; по переводу одних способов выражения концентраций в другие. Студент должен владеть навыками взвешивания веществ на технических весах и работы с лабораторным оборудованием, техникой измерения объемов жидкостей с необходимой точностью, измерения плотности растворов ареометром. 5. 2 Методические рекомендации к теме Растворами называются гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов. Между растворителем и растворенным веществом эквивалентные соотношения не наблюдаются. Этим отличаются растворы от химических соединений, имеющих постоянный состав. Однако при растворении веществ часто наблюдаются тепловые явления. Например, растворение серной кислоты, щелочи в воде сопровождается выделением тепла, а растворение в воде некоторых солей (KNO3, NH4NO3 и др.) сопровождается охлаждением раствора. Данные тепловые явления указывают на химическое взаимодействие между растворителем и растворенным веществом. Следовательно, процесс растворения является сложным физико-химическим процессом, а растворы занимают промежуточное положение между механическими смесями и химическими соединениями. Для выражения концентрации растворов существует несколько способов. Наиболее распространенные из них приведены в таблице 5. Здесь же даны и формулы перехода от одного способа выражения концентрации к другому. Таблица 5 – Формулы пересчета концентраций растворов
r - плотность раствора, М – молярная масса, М ЭКВ – молярная масса эквивалента.
Необходимо помнить, что при разбавлении растворов водой масса растворенного вещества не изменяется, поэтому W1·m1р-ра = W2 · m2р-ра (31) или W1·V1 · ρ1= W2 ·V2 ·ρ2 (32) В случае молярной концентрации и молярной концентрации эквивалента формула имеют вид: С1 · V1 = C2 · V2 (33) 5.3 Примеры решения задач Задачи на расчет концентраций При решении таких задач необходимо знать формулы концентраций (формулы 14-17). При этом следует иметь в виду, что объемы в данных формулах выражены в миллилитрах (1л = 1000 мл). Подставив в формулы значения масс растворенных веществ и масс или объемов растворов, рассчитывают нужную концентрацию раствора. Задача 1. В воде массой 300 г растворили сульфат натрия массой 30г. Какова массовая доля сульфата натрия в растворе? Решение: 1) Определяем массу раствора (необходимо помнить, что плотность воды равна 1г/мл): mр-ра = mв-ва + mводы = 30 + 300 = 330г 2) Рассчитываем массовую долю сульфата натрия по формуле 14
Задачи на расчет масс компонентов, необходимых для приготовления растворов заданной концентрации Приготовление растворов широко применяется в сельскохозяйственной практике и в быту. Простейшим способом приготовления растворовявляется растворение навески вещества в определенном количестве растворителя. При этом расчет навески производится по формулам соответствующих концентраций, решая уравнения относительно массы вещества. Задача 4. Какие массы декагидрата карбоната натрия Na2СO3 · 10H2O и воды надо взять, чтобы получить раствор массой 350г с массовой долей карбоната натрия 10%? Решение: 1) Вычислим массу карбоната натрия, необходимую для приготовления 350 г раствора: Задача 5. Сколько граммов сульфата калия необходимо для приготовления 250 мл 0,5 н. раствора? Решение: 1) Так как речь идет о молярной концентрации эквивалента, задачу будем решать по формуле 17, выразив из нее массу вещества
Задачи на переход от одной концентрации к другой При решении таких задач необходимо помнить, что каким бы способом не выражалась концентрация данного раствора масса растворенного вещества в нем постоянна, и использовать выведенные формулы взаимосвязей 19-30. Задача 6. Вычислить молярную концентрацию, молярную концентрацию эквивалента и титр 40%-ного раствора Н2SО4, плотность раствора 1,3 г/мл. Решение: 1) Рассчитываем молярную массу и молярную массу эквивалента серной кислоты: М(Н2SO4) = 98 г/моль; Мэкв(Н2SO4) = f · М(Н2SO4) = ½ · 98=49 г/моль 2) Молярную концентрацию рассчитаем по формуле 22:
Задача 8. К 300 мл 20% раствора соляной кислоты (ρ = 1,1 г/мл) прилили 250 мл воды. Определить массовую долю соляной кислоты в полученном растворе. Решение: 1)Находим массуисходного раствора: m1(p-pa) = 300 · 1,14 = 342 г; 2) Так как плотность воды равна 1 г/мл, то масса воды составляет 250г, поэтому после добавления воды масса конечного раствора равна m2(p-pa) = 342 + 250 = 592 г 3) Определяем массовую долю соляной кислоты в конечном растворе по формуле разбавления 14:
Задачи на смешение растворов При смешении растворов одного и того же вещества масса конечного раствора равна сумме масс смешиваемых растворов, а масса вещества равна сумме масс веществ исходных растворов. Задача 13. Cмешали 800 мл 3 н. раствора NaОН и 1,2л 12 %-ного раствора NaОН плотностью 1,13 г/мл. Вычислить молярную концентрацию эквивалента полученного раствора. Решение: 1) Рассчитываем массу NaОН в первом растворе по формуле 17:
W1 – массовая доля большая; W – массовая доля промежуточная; W2 – массовая доля меньшая. Значит надо взять 2 массовые части 30% - ного и 1 массовую часть 15%- ного раствора. 5.4 Лабораторная работа №3 «Приготовление раствора заданной концентрации» Цель работы: овладение способами приготовления растворов из навески растворенного вещества и путем разбавления концентрированного раствора; отработка навыков проведения необходимых расчетов, работы с химической посудой и реактивами; взвешивания на лабораторных весах; измерения объемов растворов; пользования ареометром при измерении плотности приготовленных растворов. Оборудование и реактивы: весы лабораторные, цилиндры емкостью 50 и 100 мл, конические колбы емкостью 300 мл, стеклянные палочки, ареометр, кристаллический хлорид натрия и дистиллированная вода. Выполнение работы. Опыт 1. Приготовление раствора с заданной массовой долей хлорида натрия Задание. Рассчитать массу хлорида натрия и объем воды, необходимые для приготовления 250 мл раствора с заданной массовой долей. После проверки результатов расчетов у преподавателя приступайте к приготовлению раствора. При приготовлении раствора выполните последовательно следующие операции: 1. Взвесить рассчитанную массу хлорида натрия на лабораторных весах, перенести навеску в коническую колбу емкостью 300 мл. 2. Отмерить мерным цилиндром нужный объем воды, перелить воду в стакан с навеской хлорида натрия. 3. Растворить кристаллическую соль и перелить полученный раствор в мерный цилиндр емкостью 50 мл. 4. Измерить плотность приготовленного раствора хлорида натрия с помощью ареометра. 5. Построить график зависимости W% от плотности раствора хлорида натрия, используя данные приложения 2 и определить массовую долю по измеренной плотности приготовленного раствора. 6. Рассчитать молярную концентрацию, молярную концентрацию эквивалента, титр приготовленного раствора и относительную ошибку. Данные занести в таблицу 6. Таблица 6 – Результаты опыта 1
Относительная ошибка вычисляется по формуле:
Таблица 7 – Результаты опыта 2
Относительная ошибка вычисляется по формуле: 5. 5 Тесты самоконтроля Тест 1 1. Какова массовая доля сахара в растворе, содержащем 50г сахара и 150г воды: 1) 25% 2) 33,3% 3) 30% 4) 20% 2. Сколько граммов карбоната натрия содержится в 500 мл 0,2 н. раствора: 1) 53 2) 106 3) 10,6 4) 5,3 3. Что показывает титр раствора: 1) число граммов вещества в 100г раствора; 2) число граммов вещества в 1мл раствора; 3) число граммов вещества в 1л раствора; 4) массу 1 мл раствора 4. Дисперсная система, в которой дисперсионная среда является жидкостью, а дисперсная фаза – твердым веществом, называется 1) гидрозоль 2) эмульсия 3) суспензия 4) аэрозоль 5. Какие характеристики применимы для описания истинных растворов 1) однородные системы 2) системы постоянного состава 3) системы переменного состава 4) неоднородные системы 6. Какие явления отвечают за знак и величину теплового эффекта растворения кристаллических веществ в воде 1) гидратация 2) разрушение кристаллической решетки вещества 3) диффузия частиц растворенного вещества в воде 4) все предыдущие ответы неверны 7. В растворе какого вещества молярная концентрация и молярная концентрация эквивалента совпадают? 1) КOH 2) К2CO3 3) H2SO4 4) СаCl2 8. Для приготовления 500г 20%-ного раствора необходимо иметь 90%-ный раствор массой 1) 11,1г 2) 111,1г 3) 1111г 4) 1,11г 9. Какова молярная концентрация эквивалента 1М раствора серной кислоты (при условии полной нейтрализации)? 1) 0,5н 2) 2н 3) 1н 4) 4н 10. Массовая доля раствора, полученного смешением растворов массами 130 и 120 г с массовыми долями 15 и 20 % соответственно, равна 1) 18,7 % 2) 17,4 % 3) 32,5 % 4) 43,5 % Тест 2 1. Молярная концентрация (моль/л) 0,4 н. раствора азотной кислоты равна 1) 0,4 2) 0,2 3) 0,5 4) 0,1 2. Молярная концентрация эквивалента показывает 1) число граммов вещества в 1 литре раствора 2) число моль эквивалентов вещества в 1л раствора 3) число молей вещества в 1л раствора 4) число граммов вещества в 1 мл раствора 3. Дисперсная система, в которой дисперсная фаза и дисперсионная среда жидкости, является 1) дым 2) молоко 3) туман 4) краска 4. Молярность концентрированной соляной кислоты (ρ = 1,18 г/см3), содержащей 36,5 % HCl, равна: 1) 1,18 моль/л 2) 118 моль/л 3) 5,18 моль/л 4) 11,8 моль/л 5. Масса КNO3, содержащаяся в 250 мл раствора с молярной концентрацией 0,2 моль/л составляет 1) 5,05 2) 101 3) 50,5 4) 10,1 6. Массовая доля раствора нитрата серебра, полученного смешением растворов нитрата серебра массами 140 и 180 г с массовыми долями 14 и 30 % соответственно, равна 1) 15 % 2) 23 % 3) 32 % 4) 43 % 9. Процесс растворения является 1) чисто химическим процессом 2) чисто физическим процессом 3) физико-химическим процессом 4) все ответы неверны 10. В растворе какого вещества молярная концентрация и молярная концентрация эквивалента совпадают? 1) HCl 2) К2SO3 3) H3PO4 4) СаCl2
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1032; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.156.190 (0.013 с.) |

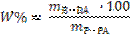 (14)
(14)
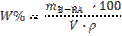 (15)
(15)
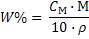 (19)
(19)
 (20)
(20)
 (21)
(21)
 (22)
(22)
 (16)
(16)
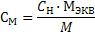 (23)
(23)
 (24)
(24)
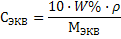 (25)
(25)
 (26)
(26)
 (17)
(17)
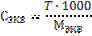 (27)
(27)
 (28)
(28)
 (29)
(29)
 (30)
(30)
 (18)
(18)
 Задача 2. Вычислите массовую долю (%) гидроксида натрия в растворе (плотность 1,100 г/мл), если 5л его содержат 506г NaOH. Решение: 1) Так как дан объем раствора, то для решения подходит формула 15:
Задача 2. Вычислите массовую долю (%) гидроксида натрия в растворе (плотность 1,100 г/мл), если 5л его содержат 506г NaOH. Решение: 1) Так как дан объем раствора, то для решения подходит формула 15: Задача 3. Вычислите молярную концентрацию, молярную концентрацию эквивалента и титр раствора ортофосфорной кислоты, если в 200 мл раствора содержится 29,4г ортофосфорной кислоты при условии ее полной нейтрализации. Решение: 1) Молярную концентрацию раствора рассчитываем по формуле 16: М(Н3РО4)=98г/моль
Задача 3. Вычислите молярную концентрацию, молярную концентрацию эквивалента и титр раствора ортофосфорной кислоты, если в 200 мл раствора содержится 29,4г ортофосфорной кислоты при условии ее полной нейтрализации. Решение: 1) Молярную концентрацию раствора рассчитываем по формуле 16: М(Н3РО4)=98г/моль 2) Рассчитаем молярную массу эквивалента ортофосфорной кислоты, учитывая что при условии полной нейтрализации ее фактор эквивалентности равен ⅓: Мэкв = f · M(H3PO4) = ⅓ · 98 = 32,7 г/моль 3) Молярную концентрацию эквивалента рассчитаем по формуле 17:
2) Рассчитаем молярную массу эквивалента ортофосфорной кислоты, учитывая что при условии полной нейтрализации ее фактор эквивалентности равен ⅓: Мэкв = f · M(H3PO4) = ⅓ · 98 = 32,7 г/моль 3) Молярную концентрацию эквивалента рассчитаем по формуле 17: 4) При вычислении титра используем формулу 18:
4) При вычислении титра используем формулу 18:

 2) Вычислим массу кристаллогидрата Na2СO3 · 10H2O, необходимого для приготовления раствора: M(Na2СO3)=106 г/моль; M(Na2СO3 · 10H2O)=286 г/моль;
2) Вычислим массу кристаллогидрата Na2СO3 · 10H2O, необходимого для приготовления раствора: M(Na2СO3)=106 г/моль; M(Na2СO3 · 10H2O)=286 г/моль; 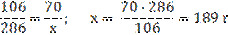 3) Вычисляем массу воды: m(p-pa) = m(H2O) + m(Na2СO3·10H2O); m(H2O) = m(p-pa) - m(Na2СO3·10H2O); m(H2O) =350–189=161 г.
3) Вычисляем массу воды: m(p-pa) = m(H2O) + m(Na2СO3·10H2O); m(H2O) = m(p-pa) - m(Na2СO3·10H2O); m(H2O) =350–189=161 г. 
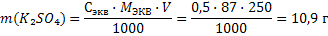 Mэкв(К2SO4) = f · M(K2SO4) = ½ · 174 = 87 г/моль
Mэкв(К2SO4) = f · M(K2SO4) = ½ · 174 = 87 г/моль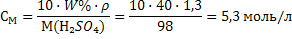 3) Молярную концентрацию эквивалента рассчитаем по формуле 25:
3) Молярную концентрацию эквивалента рассчитаем по формуле 25: 4) Рассчитываем титр раствора по формуле 28:
4) Рассчитываем титр раствора по формуле 28:  Задача 7. Определитемолярную концентрацию 2 н. раствора гидроксида бария в реакции его нейтрализации до основной соли. Решение: 1) Рассчитаем молярную массу эквивалента гидроксида бария исходя из уравнения реакции: Ba(OH)2 + НCl ↔ BaOHCl + H2O Так как замещена одна гидроксильная группа фактор эквивалентности гидроксида бария равен 1, а молярная масса эквивалента молярной массе: Мэкв= f · M(Ва(ОН)2) = 1 · 171 = 171 г/моль; 2) Молярную концентрацию рассчитываем по формуле 23:
Задача 7. Определитемолярную концентрацию 2 н. раствора гидроксида бария в реакции его нейтрализации до основной соли. Решение: 1) Рассчитаем молярную массу эквивалента гидроксида бария исходя из уравнения реакции: Ba(OH)2 + НCl ↔ BaOHCl + H2O Так как замещена одна гидроксильная группа фактор эквивалентности гидроксида бария равен 1, а молярная масса эквивалента молярной массе: Мэкв= f · M(Ва(ОН)2) = 1 · 171 = 171 г/моль; 2) Молярную концентрацию рассчитываем по формуле 23: 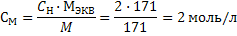 Задачи на разбавление и концентрирование растворов При приготовлении растворов методом разбавления концентрированных растворов необходимо рассчитывать не массу навески, а объем концентрированного раствора и необходимого количества воды. При этом необходимо помнить, что масса растворенного вещества не изменяется, и для расчетов подходят формулы разбавления 31-33. Иногда требуется наоборот концентрировать раствор. Это достигается либо выпариванием (кипячением), либо добавлением дополнительного количества растворенного вещества. Следует помнить, что в первом случае указанные формулы применимы, а во втором масса растворенного вещества меняется и расчеты по формулам необоснованны.
Задачи на разбавление и концентрирование растворов При приготовлении растворов методом разбавления концентрированных растворов необходимо рассчитывать не массу навески, а объем концентрированного раствора и необходимого количества воды. При этом необходимо помнить, что масса растворенного вещества не изменяется, и для расчетов подходят формулы разбавления 31-33. Иногда требуется наоборот концентрировать раствор. Это достигается либо выпариванием (кипячением), либо добавлением дополнительного количества растворенного вещества. Следует помнить, что в первом случае указанные формулы применимы, а во втором масса растворенного вещества меняется и расчеты по формулам необоснованны. Задача 9. Какой объем 96% раствора серной кислоты плотностью 1,84 г/мл, и какой объем воды необходимы для приготовления 2л аккумуляторного электролита с массовой долей серной кислоты 36,19 % (ρ=1,27 г/мл). Решение: 1) Расчет исходного концентрированного раствора удобно провести по формуле 32:
Задача 9. Какой объем 96% раствора серной кислоты плотностью 1,84 г/мл, и какой объем воды необходимы для приготовления 2л аккумуляторного электролита с массовой долей серной кислоты 36,19 % (ρ=1,27 г/мл). Решение: 1) Расчет исходного концентрированного раствора удобно провести по формуле 32: 2) Рассчитываем объем воды, который равен разности объемов: V(H₂O) =V₂ - V₁ = 2000 – 520,4= 1479,6 мл Задача 10. Сколько миллилитров 35%-ного раствора гидроксида калия (плотность раствора 1,34 г/мл) надо взять для приготовления 500 мл 0,2М
2) Рассчитываем объем воды, который равен разности объемов: V(H₂O) =V₂ - V₁ = 2000 – 520,4= 1479,6 мл Задача 10. Сколько миллилитров 35%-ного раствора гидроксида калия (плотность раствора 1,34 г/мл) надо взять для приготовления 500 мл 0,2М 2) Рассчитываем объем исходного раствора по формуле разбавления 33:
2) Рассчитываем объем исходного раствора по формуле разбавления 33: 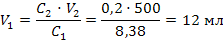 Задача 11. Какой объем воды необходимо выпарить из 1л 4%-ного раствора поваренной соли (ρ=1,027 г/мл), чтобы получить 25%-ный раствор. Решение: 1) Рассчитываем массу исходного раствора: m1(р-ра)=V1 · ρ1 =1000·1,027=1027 г 2) Рассчитываем массу конечного раствора по формуле разбавления 31:
Задача 11. Какой объем воды необходимо выпарить из 1л 4%-ного раствора поваренной соли (ρ=1,027 г/мл), чтобы получить 25%-ный раствор. Решение: 1) Рассчитываем массу исходного раствора: m1(р-ра)=V1 · ρ1 =1000·1,027=1027 г 2) Рассчитываем массу конечного раствора по формуле разбавления 31: 3) Рассчитываем массу выпаренной воды как разность масс растворов: m(H2O) = m1 – m2=1027–164,3=862,7 г. Так как плотность воды равна 1г/мл объем воды составляет 862,7 мл. Задача 12. Сколько граммов гидроксида натрия необходимо растворить в 200 мл 6%-ного раствора (плотность 1,065 г/мл), чтобы получить 10%-ный раствор (плотность 1,11 г/мл). Решение: 1) Рассчитываем массу исходного раствора: m1(р-ра) = V1 · ρ1 = 200 · 1,065 = 213г 2) Находим массу гидроксида натрия в исходном растворе по формуле 14:
3) Рассчитываем массу выпаренной воды как разность масс растворов: m(H2O) = m1 – m2=1027–164,3=862,7 г. Так как плотность воды равна 1г/мл объем воды составляет 862,7 мл. Задача 12. Сколько граммов гидроксида натрия необходимо растворить в 200 мл 6%-ного раствора (плотность 1,065 г/мл), чтобы получить 10%-ный раствор (плотность 1,11 г/мл). Решение: 1) Рассчитываем массу исходного раствора: m1(р-ра) = V1 · ρ1 = 200 · 1,065 = 213г 2) Находим массу гидроксида натрия в исходном растворе по формуле 14: 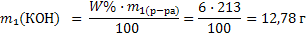 3) Пусть растворили х г гидроксида натрия, тогда масса вещества во втором растворе станет (12,78+х), масса раствора (213+х). Составляем и решаем уравнение относительно х:
3) Пусть растворили х г гидроксида натрия, тогда масса вещества во втором растворе станет (12,78+х), масса раствора (213+х). Составляем и решаем уравнение относительно х:  Масса добавленной щелочи 9,47г.
Масса добавленной щелочи 9,47г. 2) Рассчитываем массу NaОН вo втором растворе по формуле 15:
2) Рассчитываем массу NaОН вo втором растворе по формуле 15: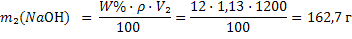 3) Объем конечного раствора равен: V3=V1+V2=800+1200=2000 мл, а масса гидроксида натрия m3(NaOH)=m1(NaOH)+m2(NaOH)=96+162,7=258,7г 4) Рассчитываем молярную концентрацию эквивалента конечного раствора по формуле 17: Мэкв=f ·M(NaOH)=1·40=40 г/моль
3) Объем конечного раствора равен: V3=V1+V2=800+1200=2000 мл, а масса гидроксида натрия m3(NaOH)=m1(NaOH)+m2(NaOH)=96+162,7=258,7г 4) Рассчитываем молярную концентрацию эквивалента конечного раствора по формуле 17: Мэкв=f ·M(NaOH)=1·40=40 г/моль Задача 14. В каких массовых отношениях нужно смешать 30%-ный и 15%-ный растворы соляной кислоты для приготовления 25% раствора. Решение: 1) Предлагаем использовать правило креста:
Задача 14. В каких массовых отношениях нужно смешать 30%-ный и 15%-ный растворы соляной кислоты для приготовления 25% раствора. Решение: 1) Предлагаем использовать правило креста:






 W1
W
W2
W1
W
W2
 Опыт 2. Приготовление однонормального раствора хлорида натрия (1н) из исходного раствора методом разбавления Задание. Рассчитать объем исходного раствора хлорида натрия для приготовления 250 мл 1н. раствора. При приготовлении раствора выполнить следующие операции: 1. Отмерить с помощью цилиндра нужный объем приготовленного раствора хлорида натрия и долить до метки «250 мл» водой. Тщательно перемешать. 2. Измерить с помощью ареометра плотность приготовленного раствора и по графику найти W% экспериментальную. 3. Зная W%эксп, рассчитать молярную концентрацию эквивалента приготовленного раствора, а также относительную ошибку. Данные занести в таблицу 7.
Опыт 2. Приготовление однонормального раствора хлорида натрия (1н) из исходного раствора методом разбавления Задание. Рассчитать объем исходного раствора хлорида натрия для приготовления 250 мл 1н. раствора. При приготовлении раствора выполнить следующие операции: 1. Отмерить с помощью цилиндра нужный объем приготовленного раствора хлорида натрия и долить до метки «250 мл» водой. Тщательно перемешать. 2. Измерить с помощью ареометра плотность приготовленного раствора и по графику найти W% экспериментальную. 3. Зная W%эксп, рассчитать молярную концентрацию эквивалента приготовленного раствора, а также относительную ошибку. Данные занести в таблицу 7. Вопросы к защите: 1. Что такое растворы? 2. Как классифицируются растворы по агрегатному состоянию? 3. Из каких компонентов состоит жидкий раствор? 4. Что является растворителем в водных и неводных растворах? 5.Что называется концентрацией раствора? 6. Каковы наиболее распространенные способы выражения концентрации растворов? 7. По какой формуле можно рассчитать массовую долю растворенного вещества? 8. По какой формуле можно рассчитать молярную концентрацию? 9. По какой формуле можно рассчитать молярную концентрацию эквивалента? 10. Что такое титр раствора? 11. Приведите примеры применения растворов в технике, сельском хозяйстве.
Вопросы к защите: 1. Что такое растворы? 2. Как классифицируются растворы по агрегатному состоянию? 3. Из каких компонентов состоит жидкий раствор? 4. Что является растворителем в водных и неводных растворах? 5.Что называется концентрацией раствора? 6. Каковы наиболее распространенные способы выражения концентрации растворов? 7. По какой формуле можно рассчитать массовую долю растворенного вещества? 8. По какой формуле можно рассчитать молярную концентрацию? 9. По какой формуле можно рассчитать молярную концентрацию эквивалента? 10. Что такое титр раствора? 11. Приведите примеры применения растворов в технике, сельском хозяйстве.


