
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 6. «Свойства растворов неэлектролитов»
6.1 Содержание программы Давление насыщенного пара разбавленных растворов. Температура кристаллизации разбавленных растворов. Температура кипения разбавленных растворов. Осмотическое давление разбавленных растворов Уровень теоретической и практической подготовки Студент должен знать понятия электролитов и неэлектролитов, основные физико-химические свойства разбавленных растворов неэлектролитов, законы Вант - Гоффа и Рауля. Студент должен уметь выполнять расчеты осмотического давления, давления насыщенного пара, температуры кипения и замерзания растворов. 6.2 Методические рекомендации к теме Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К ним относятся вещества с молекулярным строением (большинство органических веществ, газы и т.д.). Разбавленные растворы неэлектролитов обладают рядом коллигативных свойств, которые широко используются для определения молекулярной массы растворенного вещества. Данные свойства выразаются следующими законами: 1) закон Вант-Гоффа: осмотическое давление раствора прямо пропорционально его молярной концентрации:
Задача 4. К 4л воды прилили 1л метанола (ρ=0,8 г/мл). Полученный раствор залили в радиатор автомобиля. Рассчитайте минимальную температуру, при которой автомобиль можно оставлять на открытом воздухе не опасаясь, что вода в радиаторе замерзнет. Решение: 1) По известной плотности рассчитаем массу метанола: 6. 4 Практическое занятие №4 «Коллигативные свойства растворов» Цель: изучить физико-химические свойства растворов неэлектролитов и их практическое применение, отработать навыки расчетов осмотического давления, температур кипения и температур замерзания растворов неэлектролитов. Вопросы для обсуждения: 1. Что называют электролитами и неэлектролитами? Приведите примеры. 2. Чем объяснить поведение разбавленных растворов неэлектролитов подобное идеальным газам? 3. Что называют насыщенным паром? Сформулируйте 1 закон Рауля? Приведите математическое выражение закона. 4. Дайте определение молярной доли растворенного вещества и молярной концентрации раствора. 5. Что называют повышением температуры кипения? Понижением температуры замерзания? Сформулируйте 2 закон Рауля? Приведите математическое выражение закона. 6. Что такое эбуллиоскопическая и криоскопическая постоянные? Как они обозначаются и от чего зависят? 7. Что называют моляльной концентрацией? По какой формуле ее рассчитывают? 8. Что такое осмос? Осмотическое давление? 9. Приведите формулировку закона Вант-Гоффа. 10. Каково значение осмоса в природе? Какие растворы называют изотоническими? Гипертоническими? Гипотоническими? Упражнения и задачи для закрепления материала и отработки навыков: 1. К 200 мл 0,1М раствора глюкозы добавили 50 мл воды. Вычислить осмотическое давление полученного раствора глюкозы при 360С. 2. Раствор, в 300 мл которого содержится 3,72г неэлектролита, обладает при 200С осмотическим давлением 487 кПа. Определите молярную массу вещества. 3. Давление водяного пара при 1000С равно 101,33 кПа. Определите давление насыщенного пара над 15%-ным растворов мочевины СО(NH2)2 при 1000С. 4. Раствор, содержащий 1,6г неэлектролита в 250г бензола, замерзает при 5,2450С. Температура замерзания бензола 5,50С. Вычислите молярную массу растворенного неэлектролита. 5. В качестве антифриза используют раствор этиленгликоля (С2Н4(ОН)2), который заливают в радиаторы автомашин в зимнее время. Какую массу этиленгликоля необходимо добавить к 2л воды, чтобы температура замерзания понизилась на 160С? 6. Вычислите температуру кипения 5%-ного водного раствора глицерина C3Н5(OH)3.
6.5 Тесты для самопроверки Тест 1 1. Раствор, содержащий 11,6г ацетона (М=58) в 250г воды (Е=0,52) имеет температуру кипения 1) 104,20С 2) 100,10С 3) 101,040С 4) 100,420 2. Каково осмотическое давление раствора, содержащего 90,08г глюкозы С6Н12О6 в 4л раствора при 270С 1) 3,12∙105 Па 2) 1,25∙105 Па 3) 28∙103 Па 4) 1,12∙105 Па 3. По закону Рауля повышение температуры кипения пропорционально 1) молярной концентрации раствора 2) моляльной концентрации раствора 3) мольной доле растворенного вещества 4) процентной концентрации раствора 4. При растворении в растворителе нелетучего вещества температура замерзания раствора 1) понижается 2) повышается 3) не изменяется 5. Моляльная концентрация показывает 1) число граммов вещества в 1 литре раствора 2) число молей эквивалентов вещества в 1л раствора 3) число молей вещества в 1000 граммах растворителя 4) число граммов вещества в 1 мл раствора 6. 40г гидроксида натрия растворили в 90г воды. Молярная доля гидроксида натрия равна 1) 0,17 2) 0,44 3) 0,31 4) 0,20 7. Моляльная концентрация 10%-ного раствора карбоната натрия равна 1) 0,94 2) 1,05 3) 0,094 4) 0,105 8. Водный раствор глицерина (С3Н8О3) кипит при 100,52 °С. Массовая доля глицерина в растворе равна 1) 4,03 % 2) 3,02 % 3) 2,84 % 4)8,42% 9. Односторонняя диффузия определенного сорта частиц в раствор через полупроницаемую перегородку называется 1) плазмолизом 2) гидролизом 3) осмосом 4) тургором 10. По закону Вант-Гоффа осмотическое давление раствора прямо пропорционально 1) мольной доле растворенного вещества 2) моляльной концентрации раствора 3) массовой доле растворенного вещества 4) молярной концентрации раствора Тест 2 1. Сколько граммов мочевины (NH2)2СО растворили в 200г воды если температура кипения раствора повысилась на 0,3 градуса 1) 6,92 г 2) 5,74 3) 7,25г 4) 8,72 2. Каково осмотическое давление раствора если при 17°С в 250 мл его содержится 0,2 моль вещества 1) 1678 кПа 2) 1928 кПа 3) 2993 кПа 4)3075кПа 3. Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного нелетучего вещества – это закон 1) Рауля 2) Вант-Гоффа 3) Генри 4) Гесса 4. Вычислить температуру замерзания раствора, содержащего 20 г сахара С12Н22О11 в 400г воды 1) -0,110С 2) -0,270С 3) 0,110С 4) 0,270С 5. После растворения вещества в растворителе при температуре 200 С давление насыщенного пара растворителя над раствором 1) понижается 2) повышается до критического значения, затем понижается 3) не изменяется 4) повышается 6. Молярная доля растворенного вещества рассчитывается по формуле:
1)
|
|||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 929; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.139.50 (0.005 с.) |
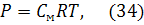 где Р - осмотическое давление раствора, кПа; С - молярная концентрация раствора; R – универсальная газовая постоянная, 8,31 Дж/(моль·К); Т – температура, К; 2) первый закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества:
где Р - осмотическое давление раствора, кПа; С - молярная концентрация раствора; R – универсальная газовая постоянная, 8,31 Дж/(моль·К); Т – температура, К; 2) первый закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества:  где р0 - давление насыщенного пара над чистым растворителем, р - давление насыщенного пара растворителя над раствором; N – молярная доля растворенного вещества рассчитывается по формуле:
где р0 - давление насыщенного пара над чистым растворителем, р - давление насыщенного пара растворителя над раствором; N – молярная доля растворенного вещества рассчитывается по формуле: 3) второй закон Рауля: повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов прямо пропорциональны моляльной концентрации растворенного вещества:
3) второй закон Рауля: повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов прямо пропорциональны моляльной концентрации растворенного вещества: 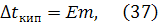
 где Е - эбуллиоскопическая постоянная, К – криоскопическая постоянная, m – моляльная концентрация, моль/кг. Моляльная концентрация (моляльность) показывает, какое количество растворенного вещества содержится в 1 кг растворителя. Ее можно рассчитывать по формуле:
где Е - эбуллиоскопическая постоянная, К – криоскопическая постоянная, m – моляльная концентрация, моль/кг. Моляльная концентрация (моляльность) показывает, какое количество растворенного вещества содержится в 1 кг растворителя. Ее можно рассчитывать по формуле:  где mв-ва – масса растворенного вещества, г; mр-ля – масса растворителя, г; М – молярная масса вещества, г/моль. 6.3 Примеры решения задач Задача 1. Вычислите осмотическое давление раствора, содержащего в 1,5л 50г глюкозы при 250С. Решение: 1) Рассчитываем молярную концентрацию раствора по формуле 16:
где mв-ва – масса растворенного вещества, г; mр-ля – масса растворителя, г; М – молярная масса вещества, г/моль. 6.3 Примеры решения задач Задача 1. Вычислите осмотическое давление раствора, содержащего в 1,5л 50г глюкозы при 250С. Решение: 1) Рассчитываем молярную концентрацию раствора по формуле 16:  2) Осмотическое давление рассчитываем по формуле 34:
2) Осмотическое давление рассчитываем по формуле 34:  Задача 2. При некоторой температуре давление пара над раствором, содержащем 62г фенола С6Н5ОН в 60 молях эфира, равно 50,7 кПа. Определите давление пара эфира при этой температуре. Решение: 1) Рассчитываем количество фенола:
Задача 2. При некоторой температуре давление пара над раствором, содержащем 62г фенола С6Н5ОН в 60 молях эфира, равно 50,7 кПа. Определите давление пара эфира при этой температуре. Решение: 1) Рассчитываем количество фенола:  2) Определяем молярную долю фенола по формуле 36:
2) Определяем молярную долю фенола по формуле 36:  3) Из формулы 35 выражаем и рассчитываем давление пара эфира:
3) Из формулы 35 выражаем и рассчитываем давление пара эфира: Задача 3. При растворении 6г некоторого неэлектролита в 200г воды температура кипения повышается на 0,26°. Вычислите молярную массу растворенного вещества. Решение: 1) Эбуллиоскопическую константу воды берем из приложения 3. Из формулы 38 выразим и рассчитаем моляльность раствора:
Задача 3. При растворении 6г некоторого неэлектролита в 200г воды температура кипения повышается на 0,26°. Вычислите молярную массу растворенного вещества. Решение: 1) Эбуллиоскопическую константу воды берем из приложения 3. Из формулы 38 выразим и рассчитаем моляльность раствора:  2) Молярную массу выражаем из формулы 39:
2) Молярную массу выражаем из формулы 39: 
 Так как плотность воды равна 1 г/мл, масса воды равна 4000г 2) Рассчитаем моляльность полученного раствора по формуле 39:
Так как плотность воды равна 1 г/мл, масса воды равна 4000г 2) Рассчитаем моляльность полученного раствора по формуле 39: 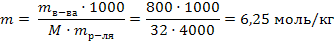 3) По закону Рауля (38) рассчитываем понижение температуры замерзания:
3) По закону Рауля (38) рассчитываем понижение температуры замерзания:  Криоскопическую константу берем из приложения 3. 4) Так как температура замерзания воды равна 00С, температура замерзания раствора tзам = 0 – 11,625 = -11,6250С. Следовательно автомобиль можно на открытом воздухе оставлять до -100С.
Криоскопическую константу берем из приложения 3. 4) Так как температура замерзания воды равна 00С, температура замерзания раствора tзам = 0 – 11,625 = -11,6250С. Следовательно автомобиль можно на открытом воздухе оставлять до -100С.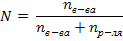 2)
2) 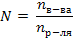 3)
3)  4)
4)  7. Смешали 9,6г метанола и 45г дистиллированной воды. Молярная доля метанола в растворе составляет (в %) 1) 21,3 2) 0,7 3) 12 4) 10,7 8. Число молей растворенного вещества, содержащихся в 1000 г растворителя, называется 1) молярной концентрацией 2) молярной концентрацией эквивалента 3) моляльной концентрацией 4) молярной долей 9. Какова моляльная концентрация 20%-ного раствора хлорида калия: 1) 3,36 2) 2,68 3) 0,336 4) 0,268 10. Какие вещества являются неэлектролитами (указать 2 ответа): 1) поваренная соль 2) сахар 3) этанол 4) калийная селитра
7. Смешали 9,6г метанола и 45г дистиллированной воды. Молярная доля метанола в растворе составляет (в %) 1) 21,3 2) 0,7 3) 12 4) 10,7 8. Число молей растворенного вещества, содержащихся в 1000 г растворителя, называется 1) молярной концентрацией 2) молярной концентрацией эквивалента 3) моляльной концентрацией 4) молярной долей 9. Какова моляльная концентрация 20%-ного раствора хлорида калия: 1) 3,36 2) 2,68 3) 0,336 4) 0,268 10. Какие вещества являются неэлектролитами (указать 2 ответа): 1) поваренная соль 2) сахар 3) этанол 4) калийная селитра


