Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 17. «физико-химические методы анализа»
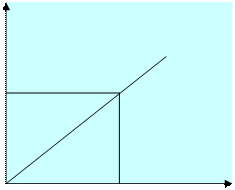
Вопросы программы Физико-химические методы анализа и их классификация. Потенциометрия. Сущность метода. Индикаторные электроды и электроды сравнения. Стеклянные электроды. Определение рН. Ион-селективные электроды. Хроматография. Спектрофотометрия. Спектры поглощения растворов. Фотометрические реакции. Закон Бугера-Ламберта-Бера. Оптическая плотность, молярный коэффициент светопоглощения. Построение калибровочного графика. Уровень теоретической и практической подготовки Студент должен знать сущность современных инструментальных методов анализа и их физико-химические основы. Студент должен уметь работать на аналитических приборах. 17.2 Методические рекомендации к теме Физико-химический анализ основан на зависимости качественного и количественного содержания элементов от какой-либо измеряемой физической величины (аналитического сигнала). Для проведения анализа необходимо выразить эту зависимость в виде графика (калибровочного) или таблиц. Для построения графиков пользуются серией стандартных растворов с точно известным содержанием определяемого элемента. Классификация методов физико-химического анализа: 1) Оптические методы основаны на измерении оптических свойств вещества. 2) Хроматографические основаны на использовании способности различных веществ к избирательной сорбции. 3) Электрохимические - на измерении электрохимических свойств веществ. 4) Радиометрические – на измерении радиоактивных свойств веществ. 5) Масс-спектрометрические - на излучении ионизированных фрагментов веществ и т.д. Рассмотрим некоторые основные физико-химические методы, применяемые в сельскохозяйственной практике. Пламенная фотометрия (фотометрия пламени) Метод пламенной фотометрии применяется как для открытия химических элементов, так и в количественных определениях в двух вариантах: эмиссионная пламенная фотометрия (пламенно-эмиссионный анализ) и абсорбционная пламенная фотометрия (пламенно-абсорбционный, атомно-абсорбционный анализ). Эмиссионная пламенная фотометрия (спектрометрия) представляет собой разновидность эмиссионного спектрального анализа. Анализируемый раствор, содержащий открываемый или определяемый химический элемент в виде его соединения, вносят в пламя горелки, распыляя его в форме аэрозоля с помощью простого пульверизатора. При температуре пламени анализируемое вещество разлагается и атомизируется. Образующиеся атомы термически возбуждаются, а затем (по истечении очень короткого времени жизни возбужденного состояния) излучают энергию возбуждения в виде фотона, что регистрируется в форме соответствующей спектральной линии пламенным фотометром. Линейчатые эмиссионные спектры атомов всех химических элементов хорошо изучены и имеются в справочниках. Атомно-абсорбционная пламенная фотометрия (атомно-абсорбциоиная пламенная спектрометрия) состоит в следующем. В пламя горелки вносится анализируемый раствор (например, распыляется в форме аэрозоля), содержащий соединение открываемого или определяемого химического элемента (натрия, калия, кальция и т. д.). В пламени горелки при высокой температуре частицы анализируемого образца разлагаются и атомизируются. Через это пламя пропускают луч света от источника возбуждения, содержащий резонансное излучение открываемого или определяемого элемента. В качестве источника возбуждения применяют лампы с полым катодом, в состав светящейся плазмы которых входят возбужденные (находящиеся в возбужденном электронном состоянии) атомы данного элемента, способные излучать свет, с длиной волны резонансного перехода. Атомы открываемого или определяемого элемента, образовавшиеся в пламени горелки при термическом разложении анализируемого образца, могут поглощать (если они находятся в невозбужденном электронном состоянии) только фотоны с длиной волны резонансного излучения этого же элемента. Например, невозбужденные атомы натрия могут поглощать только резонансное излучение атомов натрия, но не атомов другого химического элемента. Вследствие частичного поглощения невозбужденными атомами в зоне пламени интенсивность резонансного излучения (источника возбуждения) уменьшается при прохождении через пламя тем сильнее, чем больше поглощающих атомов присутствуют в зоне пламени, т. е. чем выше концентрация анализируемого раствора по определяемому элементу. Интенсивность резонансного излучения (источника возбуждения), прошедшего через пламя, регистрируется и измеряется спектральным прибором — атомно-абсорбционным пламенным фотометром или спектрофотометром. Если интенсивность резонансного излучения не уменьшается после прохождения его через пламя с анализируемым образцом, то это означает, что анализируемый образец не содержит данный элемент, резонансное излучение которого регистрируется пламенным фотометром. Если же интенсивность резонансного излучения уменьшается после прохождения через пламя с анализируемым образцом, то это указывает на присутствие данного химического элемента в анализируемом образце. В некотором интервале изменения концентраций определяемого элемента в анализируемом растворе уменьшение интенсивности резонансного излучения пропорционально при определенных условиях числу поглощающих атомов в зоне пламени и, следовательно, пропорционально концентрации раствора. На этом основано количественное определение содержания данного элемента в анализируемом образце. Спектрофотометрия. Из спектральных методов анализа наиболее широко применяют в агрохимической практике спектрофотометрию, основанную на измерении интенсивности светового потока, прошедшего через окрашенный раствор. Данный метод абсорбционного молекулярного анализа основан на использовании спектральных приборов – спектрофотометров, позволяющих регистрировать световые потоки в широком интервале изменения длин волн от 185 нм до 1100 нм, т.е. в видимой и ближней ИК области спектра. Измеряя светопоглощение окрашенного раствора (фотоколориметрический анализ), определяют содержание окрашенного вещества в испытуемом растворе. Существует зависимость между интенсивностью окраски раствора и содержанием в этом растворе окрашенного вещества. Эта зависимость (закон Бугера — Ламберта — Бера) выражается уравнением: D= εCl, где D -оптическая плотность или экстинкция, ε – коэффициент экстинкции, C – концентрация вещества, l -длина поглощающего слоя, см. Закон справедлив только для поглощения монохроматического светового потока с постоянной длиной волны. Для получения монохроматического излучения используется дифракционная решетка или светофильтр, которыми снабжены приборы. При фотоколориметрических определениях, определяя концентрацию испытуемого раствора, предварительно строят так называемую калибровочную кривую. Для этого пользуются серией эталонных растворов различной концентрации определяемого вещества. Измеряя оптическую плотность эталонных растворов, строят графическую зависимость, откладывая на оси абсцисс концентрацию С, а на оси ординат оптическую плотность D (рис.16).
 С С
Рисунок 16. Калибровочная кривая Имея такую кривую, при определении концентрации испытуемого раствора достаточно измерить его светопоглощение и по калибровочной кривой найти значение концентрации, соответствующее найденному светопоглощению. Потенциометрический метод, основанный на измерении электродвижущих сил (ЭДС) обратимых гальванических элементов, используют для определения содержания веществ в растворе и измерения различных физико-химических величин. В потенциометрии обычно применяют гальванический элемент, включающий два электрода, которые могут быть погружены в один и тот же раствор (элемент без переноса) или в два различных по составу раствора, имеющих между собой жидкостной контакт (цепь с переносом). Электрод, потенциал которого зависит от активности (концентрации) определяемых ионов в растворе, называется индикаторным. Для измерения потенциала индикаторного электрода в раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемых ионов. Такой электрод называется электродом сравнения. Величину ЭДС можно рассчитать по разности потенциалов этих электродов. Зависимость величины электродного потенциала (ЭП) от активности ионов в растворе выражается уравнением Нернста
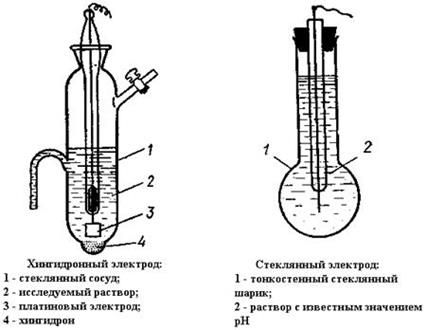
Рисунок 17. Мембранные электроды Хингидронный электрод состоит из платиновой проволоки, погруженной в раствор соляной кислоты, насыщенный хингидроном (соединение состава С6Н4О2·С6Н4(ОН)2). Схематическое обозначение хингидронного электрода: Pt│хингидрон, HCl. На хингидронном эдектроде протекает окислительно-восстановительная реакция: С6Н4О2 + 2Н+ + 2ē = С6Н4(ОН)2 Потенциал хингидронного электрода при комнатной температуре равен: Е = Ео – 0,059рН. Хингидронный электрод нельзя применять в присутствии сильных окислителей и восстановителей. 11.3 Лабораторная работа (резервная)«Фотометрическое определение меди» Цель работы: приобретение навыков работы на КФК-2, приготовления стандартных растворов. Приборы и оборудование: спектрофотометр КФК-2, колбы мерные емкостью 50 и 1000 мл, бюретки, мерные цилиндры емкостью 10 мл. Реактивы: раствор гидроксида аммония (разбавленный 1:3), концентрированная серная кислота, х. ч. сульфат меди (II) CuSO4·5H2O Выполнение работы. Определение меди проводят аммиачным методом. Он основан на образовании ионом Сu2+ с аммиаком комплекса [Сu(NH3)4]2+ окрашенного в интенсивно-синий цвет. 1. Приготовление раствора сравнения для построения градуиравочного графика. 10 мл разбавленного (1:3) гидроксида аммония переносят в мерную колбу вместимостью 50 мл, добавляют одну каплю концентрированной серной кислоты (плотность 1,84 г/см3) и доводят дистиллированной водой до метки (нулевой раствор). 2. Приготовление стандартного раствора соли меди. 3,927 г х. ч. сульфата меди CuSO4·5H2O переносят в мерную колбу вместимостью 1000 мл, растворяют, приливают 5 мл концентрированной H2SO4 (ρ = 1,84 г/см3) и доводят водой до метки, 1 мл этого раствора содержит 1 мг иона Сu2+ 3. Построение градуировочного графика. В шесть мерных колб вместимостью по 50 мл отмеряют пипетками соответственно 25, 20, 15, 10, 5 и 3 мл стандартного раствора соли меди. В каждую прибавляют по 10 мл разбавленного (1:3) раствора гидроксида аммония и доводят объем дистиллированной водой до метки. Измерение оптической плотности D начинают с раствора, имеющего наибольшую концентрацию меди. Для этого раствор из колбы наливают в кювету с рабочей длиной 1 см и измеряют оптическую плотность раствора при красном светофильтре (670 нм). Результаты оформляют в виде таблицы 16.
Таблица 16 – Концентрация (С) и оптическая плотность (D) стандартных растворов
По результатам измерений строят градуировочный график, откладывая по горизонтальной оси известные концентрации иона Сu2+, а по вертикальной - соответствующие им оптические плотности. 4. Ход определения меди в контрольном растворе. В мерную колбу с определенным количеством испытуемого раствора добавляют 1 каплю концентрированной серной кислоты, нейтрализуют 10 мл разбавленного раствора (1:3) гидроксида аммония и доводят объем в колбе водой до метки. Раствор тщательно перемешивается, наполняется им кювета с рабочей длиной 1 см и измеряют оптическую плотность его при красном светофильтре, т. е. при тех же условиях, при каких был получен градуировочный график. Зная величину оптической плотности, находят по графику концентрацию иона Сu2+ в миллиграммах на 1 мл раствора. Массу меди (в мг) в анализируемом растворе рассчитывают по формуле: mCu2+ = C · V, где С - концентрация иона меди (в мг/мл; V – объем раствора (50 мл). Результат анализа: в контрольном растворе объемом 50 мл содержится ….. мг меди Cu2+. Вопросы к защите: 1. В чем сущность оптических методов анализа? Приведите классификацию оптических методов. 2. Что такое спектр? Эмиссионная спектроскопия? 3. Сущность пламенной фотометрии и где она применяется в сельском хозяйстве? 4. В чем сущность спектрофотометрии? Каковы ее преимущества и область применения? 5. Закон Бугера-Ламберта-Бера. Что такое оптическая плотность? От чего она зависит? 6. Что служит сигналом в спектрофотометрии? 11.4 Лабораторная работа (резервная)«Реакции обнаружения катионов и анионов в растворе» Цель работы: отработка навыков проведения аналитических реакций и работы с аналитическими реактивами. Оборудование и реактивы: штатив с пробирками, стеклянная палочка, спиртовка, пробиркодержатель, плитка лабораторная, солиаммония, калия, натрия, магния, кальция, железа (II) и (III), меди (II), кобальта (II) и т.д. Выполнение работы. Опыт 1. Реакции обнаружения иона аммония. а) в пробирку вносят 8-10 капель раствора соли аммония, прибавляют такой же объем раствора щелочи и осторожно нагревают раствор. Над раствором помещают влажную индикаторную бумагу, не касаясь ею стенок пробирки. Выделяющиеся пары аммиака окрашивают бумагу в синий цвет. б) К раствору соли аммония прибавляют такой же объем реактива Несслера. Образуется оранжевый осадок: NH4CI + 2K2HgI4 + 4KOH = [ Hg2ONH2]I↓ + 7KI + KCI + 3H2O Опыт 2. Обнаружение К+ - ионов К нейтральному или уксуснокислому раствору соли калия прибавьте равный объем раствора гексанитрокобальтата (III) натрия, потрите стеклянной палочкой о стенки пробирки и слегка нагрейте на водяной бане. При этом образуется желтый осадок двойной соли гексанитрокобальтата (III) натрия-калия K2Na[Co(NO2)6]. Напишите молекулярные и ионно-молекулярные уравнения реакций.Реакцию желательно проводить при pH = 3, что соответствует разбавленным растворам уксусной кислоты, ни в коем случае pH не должен быть более 7. Опыт 3. Обнаружение Mg2+ - ионов К 1-2 каплям раствора, содержащего ионы магния, прибавляют 2-3 капли 2М НCI, 1 каплю раствора Na2HPO4 и при перемешивании по каплям прибавляют 2М NH3 до появления запаха аммиака (рН 9). Выпадает белый кристаллический осадок состава МgNH4PO4 ∙6H2O. Напишите молекулярные и ионно-молекулярные уравнения реакций. Опыт 4. Обнаружение Ca2+ - ионов Налейте в пробирку раствор соли кальция и добавьте уксусной кислоты до кислой реакции (2-3 см3). Реакцию среды проверьте при помощи метилового красного. Добавьте по каплям раствор оксалата аммония. При этом из концентрированного раствора сразу, а из разбавленного постепенно выпадает белый кристаллический осадок оксалата кальция: CaCl2 + (NH4)2C2O4 → ↓ CaC2O4 + 2NH4Cl Ca2++ C2O42 -→ ↓ CaC2O4 Ионы магния, бария, стронция мешают обнаружению ионов кальция этой реакцией, так как они тоже образуют малорастворимые осадки соответствующих оксалатов. Опыт 5. Обнаружение Fe2+ и Fe3+ - ионов а) В пробирку с раствором соли Мора прибавьте несколько капель раствора красной кровяной соли. Наблюдайте образование «турнбулевой сини». Напишите уравнение реакции. б) В пробирку с подкисленным раствором соли железа (III) прибавьте по каплям раствор желтой кровяной соли. При этом происходит образование темно-синего осадка «берлинской лазури». Напишите Опыт 6. Обнаружение Co2+ - ионов Поместите в пробирку 1-2 см3 соли кобальта (II), прибавьте несколько капель концентрированного раствора роданида аммония и содержимое пробирки тщательно перемешайте. При этом образуется комплексное соединение (NH4)2[Co(SСN)4]. К полученному раствору добавьте немного изоамилового спиртом и тщательно перемешайте. При этом роданидный комплекс кобальта переходит в слой органического растворителя, окрашивая его в интенсивно-синий цвет. Опыт 7. Обнаружение Cu2+ - ионов а) К 2-3 каплям раствора, содержащего ионы меди (II), прибавляют 1-2 капли раствора гексацианоферрат (II) калия. Наблюдайте образование красно-бурого осадка состава Сu2[Fe(CN)6]. Напишите уравнение реакции.б) В пробирку с раствором сульфата меди (II) прибавьте избыток разбавленного раствора аммиака. При этом образуется растворимое комплексное соединение синего цвета: CuSO4 · 5H2O + 4NH3 = [Cu(NH3)4]SO4 · H2O + 4H2O Опыт 8. Обнаружение Cl-, I- - ионов В две пробирки с растворами хлорида и иодида калия добавьте раствор нитрата серебра (примерно 1/3 от объема растворов соли). Наблюдайте образование белого и желтого осадков. Добавьте в обе пробирки с осадками избыток раствора аммиака и перемешайте. Обратите внимание, что осадок хлорида серебра полностью растворяется в аммиаке, в иодид серебра - практически не растворяется. Напишите молекулярные и ионно-молекулярные уравнения реакций. Опыт 9. Обнаружение SO4 2- – ионов Поместите в пробирку 1 см3 раствора сульфата натрия и прибавьте столько же раствора хлорида бария. Наблюдайте образование кристаллического осадка сульфата бария. Растворяется ли осадок в соляной кислоте? Опыт 10. Обнаружение СО32- - ионов Карбонаты и гидрокарбонаты при взаимодействии с кислотами выделяют диоксид углерода. В пробирку с раствором карбоната калия или натрия добавьте немного раствора соляной или серной кислоты. Наблюдайте выделение диоксида углерода. Проверьте, что и нерастворимый карбонат кальция при взаимодействии с кислотой выделяет диоксид углерода. Напишите уравнения реакций. Опыт 11. Обнаружение SO32- - ионов В пробирку с раствором сульфита (гидросульфита) натрия или калия прибавьте 2-3 см3 раствора соляной (серной) кислоты. Выделение удушливого сернистого газа свидетельствует о присутствии в растворе S032- -ионов. Напишите уравнение реакции. Опыт 12. Обнаружение NO3- - ионов Всухую пробирку поместите 0,5 см3 раствора дифениламина, добавьте 4-5 капель концентрированной серной кислоты и 3 - 4 капли раствора нитрата калия. Быстро окисляясь в кислой среде под действием NО3- - ионов, дифениламин образует соединение синего цвета. Вопросы к коллоквиуму №1 на тему: «Химическая термодинамика. Кинетика. Химическое равновесие. Растворы». 1. Химическая термодинамика. Основные законы термодинамики. 2. Тепловые эффекты реакций. Закон Гесса. 3. Энергетика химических процессов. Внутренняя энергия, энтальпия, энтропия. Свободная энергия Гиббса. 4. Скорость химических реакций и методы ее регулирования. Зависимость скорости реакции от температуры. Энергия активации. Уравнение Аррениуса. 5. Кинетика химических реакции. Закон действующих масс. 6. Катализ. Гомогенный и гетерогенный катализ. Ферментативный катализ. 7. Химическое равновесие и закон действующих масс. Смещение химического равновесия. Принцип Ле Шателье. 8. Химическая теория образования растворов, Сольваты, гидраты, тепловой эффект растворения. Роль растворов в природе. 9. Дисперсные системы. Растворы. Способы выражения концентрации растворов. 10. Свойства растворов неэлектролитов. Законы Рауля и Вант-Гоффа. 11. Теория электролитической диссоциации Аррениуса. Диссоциация кислот, оснований, солей. 12. Сильные электролиты. Активность и коэффициент активности. Ионная сила раствора. 13. Слабые электролиты. Степень и константа диссоциации. Закон разбавления Оствальда. 14. Диссоциация воды. Ионное произведение воды. Водородный показатель. Роль концентрации водородных ионов в биологических процессах. 15. Буферные системы. Свойства буферных растворов. Механизм буферного действия. Буферная емкость. Роль буферных систем в биологических процессах. 16. Гидролиз солей. Типы гидролиза. Константа и степень гидролиза. ПРИМЕР письменного задания к коллоквиуму на тему: «Химическая термодинамика. Кинетика. Химическое равновесие. Растворы». 1. Напишите формулировку закона Гесса и его следствия и поясните их на конкретном примере. Исходя из двух термохимических
Вопросы к коллоквиуму №2 на тему: «Строение атома. Химическая связь. Периодический закон Д.И. Менделеева. Окислительно-восстановительные свойства веществ» 1. Строение атома. Планетарная и квантово-механическая модель. Квантовые числа. Принцип Паули. Правило Хунда. Правило Клечковского. 2. Периодический закон Д.И.Менделеева и его трактовка на основании современной теории строения атома. 3. Структура периодической системы элементов: периоды, группы, электронные семейства (s-, р- , d -,f-элементы ). 4. Свойстваатомов: атомный радиус, потенциал ионизации, сродство к электрону, электроотрицательность, степень окисления и характер их изменения в группе и периоде. 5. Основныетипы химической связи: ковалентная, ионная, водородная и металлическая. Характеристики связи. 6. Ковалентная полярная и неполярная связи. Квантово-механическое объяснение ковалентной связи. Донорно-акцепторнаясвязь. 7. Гибридизацияатомных орбиталей. Строение молекул. 8. Кратные связи. Механизм образования двойных и тройных связей, σ- и π- связи. Энергия и длина связи. 9. Степень окисления и правила ее определения. 10. Сущность теории окислительно-восстановительных реакций. Важнейшие окислители и восстановители. 11. Окислительно-восстановительные потенциалы. Стандартные окислительно-восстановительные потенциалы. Электродные потенциалы. Уравнение Нернста. 12. Электролиз. Катодные и анодные процессы при электролизе. Законы электролиза. 13. Химические источники тока. 14. Коррозия металлов и методы борьбы с ней. ПРИМЕР письменного задания к коллоквиуму на тему: «Строение атома. Химическая связь. Периодический закон Д.И. Менделеева. Окислительно-восстановительные свойства веществ».1.Для атома фосфора: а) напишите полную электронную формулу; б) валентные электроны покажите электронно-графическим способом; в) определите число неспаренных электронов в нормальном состоянии и возможное число неспаренных электронов в возбужденном Атомные номера химических элементов 19 и 35. Не пользуясь 6. Какая часть гальванического элемента называется электродом?
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 751; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.100.120 (0.04 с.) |
 где Ео - стандартный электродный потенциал; п - число электронов (ē), участвующих в реакции;
где Ео - стандартный электродный потенциал; п - число электронов (ē), участвующих в реакции;  - концентрация, моль/л. В потенциометрическом методе анализа используют два основных класса электродов: - электроды, на межфазных границах которых протекают реакции с участием электронов, так называемые электронообменные (электроды первого, второго рода и окислительно-восстановительные); - электроды, на межфазных границах которых протекают ионообменные реакции. Такие электроды называют мембранными, или ионообменными, их называют также ионоселективными. Обратимые электроды - электроды, у которых скачки потенциалов зависят от концентрации в соответствии с термодинамическими уравнениями. На обратимых электродах быстро устанавливается равновесие, и скачки потенциалов остаются неизменными во времени. При прохождении электрического тока скачки потенциалов не должны значительно изменяться; а после выключения тока быстро должно устанавливаться равновесие. Электроды, не удовлетворяющие этим требованиям, называются необратимыми. В потенциометрии используют обратимые электроды. Электроды I рода — электроды, находящиеся в равновесии с катионами, одноименными с металлом, и обратимые по отношению к ним. Простейший электронообменный электрод — металлическая пластинка, погруженная в раствор или расплав электролита Zn/Zn2+; Сu/Сu2+ и т. д. В качестве электрода сравнения используют стандартный водородный электрод (СВЭ) — электрод I рода. Его потенциал определяется величиной рН и при комнатной температуре равен: Е = Ео + 0,0591g[H+] = -0,059рН Стандартный водородный электрод (СВЭ) неудобен в работе, его заменяют электродами II рода — насыщенным каломельным электродом (н.к.э.) и хлорсеребряным (х.с.э.). Электроды II рода — электроды, состоящие из металлической пластинки, покрытой малорастворимой солью этого металла, и обратимые по отношению к анионам соли: а) хлорсеребряные электроды состоят из серебряной проволоки, покрытой малорастворимой в воде солью AgCl, погружённой в водный раствор КСl. На электроде протекает реакция АgCl +ē ↔ Ag+ + Cl-; б) каломельный Нg/Hg22+,КСl состоит из металлической ртути, покрытой пастой малорастворимого Hg2Cl2 - каломели, контактирующие с водным раствором КСl. Мембранные (ион-селективные) электроды - электроды обратимые по тем или иным ионам, сорбируемым твердой или жидкой мембраной. Реальный потенциал таких электродов зависит от активности тех ионов в растворе, которые сорбируются мембраной. Мембранные электроды используют в качестве индикаторных при определении различных катионов (Li+, Na+, K+, Mg2+, Ca2+, Cd2+ и т.д.) и анионов (F-, Cl-, S2-, NO3- и др.). Среди ионоселективных электродов наибольшее применение получили стеклянный и хингидронный электроды, предназначенные для измерения рН (рис. 17).
- концентрация, моль/л. В потенциометрическом методе анализа используют два основных класса электродов: - электроды, на межфазных границах которых протекают реакции с участием электронов, так называемые электронообменные (электроды первого, второго рода и окислительно-восстановительные); - электроды, на межфазных границах которых протекают ионообменные реакции. Такие электроды называют мембранными, или ионообменными, их называют также ионоселективными. Обратимые электроды - электроды, у которых скачки потенциалов зависят от концентрации в соответствии с термодинамическими уравнениями. На обратимых электродах быстро устанавливается равновесие, и скачки потенциалов остаются неизменными во времени. При прохождении электрического тока скачки потенциалов не должны значительно изменяться; а после выключения тока быстро должно устанавливаться равновесие. Электроды, не удовлетворяющие этим требованиям, называются необратимыми. В потенциометрии используют обратимые электроды. Электроды I рода — электроды, находящиеся в равновесии с катионами, одноименными с металлом, и обратимые по отношению к ним. Простейший электронообменный электрод — металлическая пластинка, погруженная в раствор или расплав электролита Zn/Zn2+; Сu/Сu2+ и т. д. В качестве электрода сравнения используют стандартный водородный электрод (СВЭ) — электрод I рода. Его потенциал определяется величиной рН и при комнатной температуре равен: Е = Ео + 0,0591g[H+] = -0,059рН Стандартный водородный электрод (СВЭ) неудобен в работе, его заменяют электродами II рода — насыщенным каломельным электродом (н.к.э.) и хлорсеребряным (х.с.э.). Электроды II рода — электроды, состоящие из металлической пластинки, покрытой малорастворимой солью этого металла, и обратимые по отношению к анионам соли: а) хлорсеребряные электроды состоят из серебряной проволоки, покрытой малорастворимой в воде солью AgCl, погружённой в водный раствор КСl. На электроде протекает реакция АgCl +ē ↔ Ag+ + Cl-; б) каломельный Нg/Hg22+,КСl состоит из металлической ртути, покрытой пастой малорастворимого Hg2Cl2 - каломели, контактирующие с водным раствором КСl. Мембранные (ион-селективные) электроды - электроды обратимые по тем или иным ионам, сорбируемым твердой или жидкой мембраной. Реальный потенциал таких электродов зависит от активности тех ионов в растворе, которые сорбируются мембраной. Мембранные электроды используют в качестве индикаторных при определении различных катионов (Li+, Na+, K+, Mg2+, Ca2+, Cd2+ и т.д.) и анионов (F-, Cl-, S2-, NO3- и др.). Среди ионоселективных электродов наибольшее применение получили стеклянный и хингидронный электроды, предназначенные для измерения рН (рис. 17).