Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные типы диаграмм фазового равновесияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Рассмотрим наиболее распространенные типы диаграмм фазового равновесия (в дальнейшем – диаграмм состояния) бинарных систем, построенных на основе термографического и микроскопического анализов (рис. 1). Диаграммы состояния непрерывных твердых растворов Если компоненты А и В по строению электронных оболочек атомов, их радиусам и энергиям химических связей достаточно близки между собой и их замена друг другом не связана с затруднениями структурного и энергетического характера, то обычно возникают непрерывные твердые растворы (рис.2). Над линией ликвидуса l лежит область расплава L, под линией солидуса s – область твердого раствора S, между ними – область кристаллизации. Рассмотрим особенности кристаллизации систем этого типа (рис.2, а). При составе, соответствующем фигуративной точке Ф1, охлаждаем расплав до точки l'. Начинают выпадать кристаллы состава s'. При охлаждении до точки К"выпадут кристаллы s", состав расплава отвечает точке I". По мере охлаждения состав кристаллов изменяется по кривой s – s"– s"', состав расплава – по кривой l' – l" – l'". Соотношение количества выпавших кристаллов и доли расплава равно отношению отрезков Kl: Ks коноды l s. В точке s'" расплав окончательно кристаллизуется. В качестве примера диаграмм состояния непрерывных твердых растворов на рис. 2, б приведена реальная диаграмма состояния системы Ag–Au. Диаграммы состояния непрерывных твердых растворов могут иметь максимум или минимум (рис. 3).
Рис. 1. Важнейшие типы диаграмм состояния в бинарных системах (по В.А. Немилову)
Рис. 2. Диаграммы состояния непрерывных твердых растворов: а – ход кристаллизации в таких системах; б – диаграмма состояния системы Ag–Au
Рис. 3. Диаграммы состояния непрерывных твердых растворов с максимумом или минимумом. Примером первого случая является система Pb–Ti, примером второго – система Cu–Mn
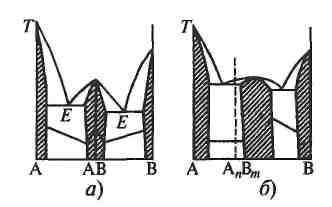
Эвтектическая диаграмма состояния а) Без областей твердых растворов Эвтектическая диаграмма состояния имеет два максимума, соответствующих чистым компонентам А и В, и четкий минимум, соответствующий эвтектической точке Е (рис. 4). Способ построения диаграммы показан на рис. 4, а и б. Кривые охлаждения составов А, В и Е имеют горизонтальные площадки, соответствующие температурам кристаллизации расплавов этих составов. Как видно на рис. 4, б, диаграмма состояния разделена на три части: • верхнее поле расплава L, ограниченное снизу линией ликвидуса /; • нижнее поле твердых фаз S, ограниченное сверху линией солидуса s; • область кристаллизации (ОК) – между линиями / и s. Линии ликвидуса и солидуса соприкасаются в эвтектической точке Е. Форма эвтектической диаграммы зависит от разности температур плавления компонентов А и В. Если температуры плавления близки, точка Е лежит примерно посередине диаграммы. Если температуры плавления сильно отличаются, точка Е смещается к точке плавления низкоплавкого компонента и в пределе сливается или почти сливается с ней (рис. 4, в). На рис. 4, г представлена диаграмма состояния с ретроградной растворимостью. В этом случае растворимость компонента В с повышением температуры от точки tE сперва падает до точки lа, затем снова растет. При нагревании от tE до l кристаллы компонента В выпадают, а при дальнейшем нагревании снова растворяются. Микроструктура шлифов для составов, отвечающих фигуративным точкам на рис. 4, а и б, представлена на рис. 4, д. На рис. 5, б приведена диаграмма состояния системы Ag–Cu. При кристаллизации составов, лежащих влево от эвтектической точки, выпадает твердый раствор меди в серебре (фаза α); при кристаллизации составов, лежащих вправо от эвтектической точки, – твердый раствор серебра в меди (фаза (3). При температуре tE= 779°С состав этих твердых растворов равен, соответственно, 8,8 и 8,0 вес.% растворенного компонента. Диаграмма состояния с химическим соединением Диаграммы состояния такого типа состоят как бы из двух более простых диаграмм, причем максимум на линии ликвидуса является точкой, разделяющей диаграмму. а) Без областей твердых растворов Если в системе А – В образуется химическое соединение, например АВ (или АтВп), то на диаграмме состояния возникает сингулярная точка D (от лат. singularis – отдельный, особый), разделяющая диаграмму на две эвтектические диаграммы с эвтектическими точками E1 и Е2 (рис. 6, а). Заслуживает внимания острота пика максимума. Если пик острый, плавление является конгруэнтным, т.е. без разложения. Если пик пологий – плавление инконгруэнтное, т.е. с разложением. На рис. 6, б приведен пример диаграммы состояния с химическим соединением Mg2Sn. Наличие сингулярной точки подтверждается не только максимумом на кривой плавления, но и минимумом на кривой электропроводности.
Рис. 4. Эвтектическая диаграмма состояния: а – кривые охлаждения, отвечающие разным сингулярным точкам; б, в, г – вид диаграмм состояния; д – микроструктуры сплавов, составы которых указаны соответствующими буквами на рис. 4, б
Рис. 5. Эвтектическая диаграмма состояния с областями твердых растворов: а – общий вид диаграммы; б – диаграмма состояния системы Ag–Сu
Рис. 6. Диаграмма состояния с химическим соединением без областей твердых растров: а – общий вид диаграммы с сингулярной точкой; б – диаграмма состояния системы Mg–Sn Пологий пик имеется на кривой не только ликвидуса, но и солидуса, т.е. фаза диссоциирует и в жидком, и в твердом состоянии б) С областями твердых растворов Если химическое соединение, на котором основана фаза переменного состава, лежит в пределах ее области гомогенности, то эта фаза называется дальтонидом (рис. 7, а), а если за пределами области гомогенности, то бертоллидом (рис. 7, б).
Рис. 7. Диаграммы состояния с химическими соединениями и областями твердых растворов: а – с дальтонидной фазой; б – с бертоллидной фазой.
|
||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 942; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.236.93 (0.006 с.) |