
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
А. В. Черноглазова, Ф. Н. КуртаеваСодержание книги
Поиск на нашем сайте
КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ Им. А.Н.ТУПОЛЕВА
А.В. ЧЕРНОГЛАЗОВА, Ф.Н.КУРТАЕВА МАТЕРИАЛОВЕДЕНИЕ Практикум Казань 2011
Министерство образования Российской Федерации
КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. А.Н.ТУПОЛЕВА
БУГУЛЬМИНСКИЙ ФИЛИАЛ _______________________________________________________________
А.В. ЧЕРНОГЛАЗОВА, Ф.Н.КУРТАЕВА
МАТЕРИАЛОВЕДЕНИЕ
Практикум
Под редакцией проф.Э.Р.Галимова
Рекомендовано к печати Учебно-методическим центром КГТУ им. А.Н.Туполева
Бугульма 2011 УДК 620.1(076.5)
А.В. ЧЕРНОГЛАЗОВА, Ф.Н.КУРТАЕВА: «Материаловедение» Практикум Казань: Изд-во Казан. гос. техн. ун-та
ISBN
Приводится описание основных типов диаграмм фазового равновесия реальных двойных систем, возможности их использования для изучения превращений, происходящих в сплавах, анализа и расчета фазового и структурного составов системы при заданных температурах; дается анализ превращений, происходящих в сплавах системы «железо – цементит», при образовании фаз и структур, и рассматриваются способы определения состава и весового количества фаз при заданных температурах. Приводится описание основных видов термической обработки, превращений происходящих при нагреве, при охлаждении сталей. Рассмотрено влияние скорости охлаждения на структуру и свойства стали.
Предназначено для научных сотрудников и студентов направлениям 150600, 150700. 160100
Табл.11. Ил24. Библиогр.: назв.
Рецензент: докт.хим.наук, профессор Казанского государственного технологического университета. Р.З.Гильманов
ISBN Ó Изд-во Казан. гос. техн. ун-та,2011. Ó А.В.Черноглазова,Ф.Н.Куртаева, 2011.
Практическое занятие №1 АНАЛИЗ ДИАГРАММ ФАЗОВОГО РАВНОВЕСИЯ
При выборе материалов для изготовления различного рода изделий, использующихся в широком диапазоне условий эксплуатации, необходима оценка их физико-химических, механических и технологических свойств и возможностей изменения последних. Рациональный подход к такой оценке дают знание диаграмм фазового равновесия и умение их анализировать. К настоящему времени изучено около 10 тыс. диаграмм состояния двойных систем, и число их продолжает расти.
Цель практической работы – изучение основных типов диаграмм фазового равновесия реальных двойных систем, приобретение практических навыков их использования для изучения превращений, происходящих в сплавах, анализа и расчета фазового и структурного составов системы при заданной температуре. Основы теории 1.1. Способ и условия построения диаграмм фазового равновесия Для построения диаграмм фазового равновесия используют термический анализ. Для этой цели экспериментально получают кривые охлаждения отдельных сплавов и по их перегибам или остановкам, связанным с тепловыми эффектами превращений, определяют температуры соответствующих превращений. Эти температуры называют критическими точками. Для количественного и качественного изучения этих превращений в твердом состоянии используют различные методы физико-химического анализа: микроанализ, рентгеноструктурный, магнитный и др. Как правило, диаграммы фазового равновесия строят в координатах температура – концентрация в процентах по массе или атомных процентах компонента. Диаграммы фазового равновесия в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации компонентов и дают наглядное представление о процессах, происходящих в сплавах системы при нагреве и охлаждении. Пример построения диаграммы фазового равновесия приводится в подразделе «Эвтектическая диаграмма состояния непрерывных твердых растворов», а для системы «олово – цинк» – в приложении П1. Практическая часть 2.1. Порядок выполнения работы Для выполнения задания необходимо: 2.1.1. Получить у преподавателя номер варианта и выписать индивидуальное задание из таблицы 1. 2.1.2. Начертить в масштабе анализируемую диаграмму состояния. 2.1.3. Дать буквенные обозначения всем линиям диаграммы состояния. 2.1.4. Определить, к какому типу (см. рис. 1) относится диаграмма состояния. 2.1.5. Провести фазовый и структурный анализы диаграммы состояния. 2.1.6. Рассчитать составы твердых растворов (при их наличии в системе). 2.1.7. Написать практическую часть отчета о работе в соответствии с вышеуказанными пунктами задания.
Таблица 1. Перечень диаграмм состояния двойных систем для выполнения индивидуального задания.
Примечание. Для всех вариантов соответствующие диаграммы состояний приведены в приложении I.
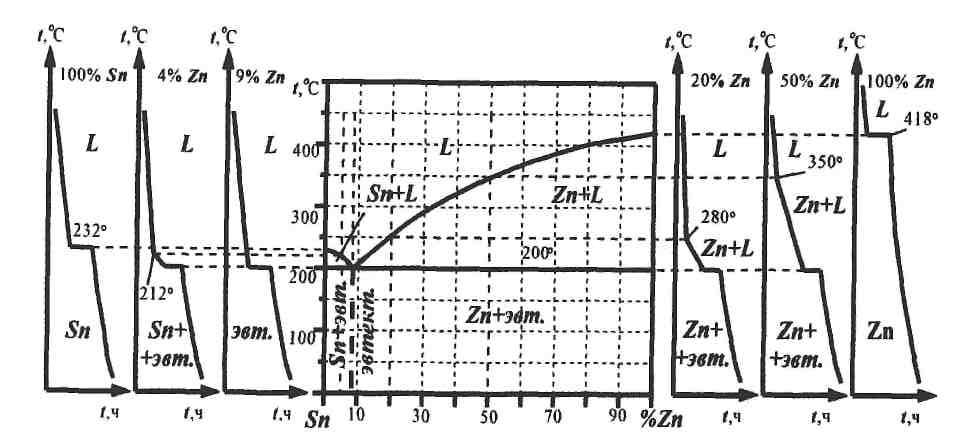
2.2 Пример построения диаграммы состояния (система «олово – цинк») Для построения диаграммы методом термического анализа необходимо получить кривые охлаждения чистых металлов и ряда их сплавов. В данном случае проведено исследование чистых металлов олова и цинка, а также их сплавов: доэвтектического (4% Zn + 96% Sn), эвтектического (9% Zn + 91% Sn) и двух сплавов заэвтектических (20% Zn + 80% Sn и 50% Zn + 50% Sn) составов (рис. 8). После проведения термического анализа указанных металлов и сплавов для получения критических точек необходимо построить кривые их кристаллизации. По полученным данным строится диаграмма состояния системы Sn – Zn (см. рис.8). Для теоретической проверки правильности построения диаграммы состояния и анализа кривых охлаждения пользуются правилом фаз: С=К-Ф+1, где С – число степеней свободы, т.е. число изменяющихся внешних и внутренних факторов (температура, концентрация, давление); К– число компонентов; Ф – число фаз. Под числом степеней свободы системы понимается число независимых переменных факторов, которое можно изменить при сохранении числа фаз в системе. В качестве примера рассмотрим кристаллизацию сплавов системы Sn – Zn (см. рис.8). Кристаллизация сплава эвтектического состава этой системы (9% Zn + 91% Sn) происходит при постоянной температуре, и в системе сосуществуют три фазы (жидкость + кристаллы цинка + + кристаллы олова). В соответствии с правилом фаз число степеней свободы равно нулю:
С=К-Ф+ 1 = 2-3+ 1 = 0, т.е. система безвариантна, и любое изменение температуры или концентрации вызовет нарушение равновесия. Наличие горизонтального участка на кривой охлаждения (см. рис. 8) сплава показывает постоянство температуры. Температура остается постоянной до полного исчезновения одной из фаз, т.е. жидкости. Кристаллизация до- и заэвтектических сплавов происходит в интервале температур между линиями ликвидуса и солидуса. При этом сплавы состоят из кристаллов олова и цинка в зависимости от состава жидкости, т.е. Ф–2. Число степеней свободы равно единице: С= 2 – 2+1 = 1. Здесь система одновариантна, что позволяет, сохраняя равновесие сплава, произвольно менять либо температуру (зависимой переменной будет концентрация), либо концентрацию (зависимой переменной будет температура). В системе олово – цинк при комнатной температуре существуют две твердые фазы: кристаллы олова и цинка. Взаимная растворимость этих металлов в твердом состоянии незначительна, поэтому олово и цинк практически считают не растворяющимися друг в друге. По составу и структуре сплавы данной системы делятся на доэвтектические, эвтектические и заэвтектические.
Рис. 8 Кривые охлаждения сплавов системы Sn-Zn и ее диаграмма состояния Структура доэвтектических сплавов (менее 9% Zn) состоит из избыточных кристаллов олова и эвтектики. Микроструктура эвтектического сплава, содержащего 9% Zn и 91% Sn, состоит из механической смеси мелких зерен двух фаз – олова и цинка. Структура заэвтектических сплавов (более 9% Zn) состоит из избыточных кристаллов цинка и эвтектики. 3. Термины и определения. Диаграмма фазового равновесия (диаграмма состояния) – графическое изображение соотношения между параметрами состояния (температурой, давлением, составом) термодинамически равновесной системы, т.е. фазового состояния любого сплава изучаемой системы компонент в зависимости от его концентрации. Компонент – составная часть, в данном случае химический элемент, образующий сплав. Конода – горизонтальный отрезок, концы которого ограничены равновесными сосуществующими фазами и содержанием в них компонентов; характеризует состав фаз, находящихся в равновесии. Ликвидус – геометрическое место точек начала затвердевания бинарных сплавов с различным содержанием компонентов на диаграмме состояния. Линии фигуративных точек – вертикальные линии на диаграмме состояния, соответствующие определенному химическому составу сплава. Линия предельной растворимости – линия на диаграмме состояния бинарных сплавов, характеризующая изменение растворимости компонента с изменением температуры. Перитектика – структурная составляющая сплава, представляющая собой механическую смесь фаз, образующуюся за счет ранее выделившейся твердой фазы и закристаллизовавшейся жидкой части сплава определенного состава. Раствор твердый – однофазный в твердом состоянии сплав, в котором соотношение компонент может быть переменным и один из компонентов (растворитель) сохраняет свою кристаллическую решетку, а атомы другого (или других) компонента располагаются в решетке этого компонента, изменяя ее размеры (периоды решетки).
Система (гетерогенная) – макроскопически неоднородная термодинамическая система, состоящая из различных по физическим свойствам или химическому составу частей (фаз). Соединение химическое – фаза, кристаллическая решетка которой отличается от решеток компонентов, ее образующих. В химическом соединении всегда сохраняется простое кратное соотношение компонентов АmВn, где m и n – простые числа. Солидус – на диаграмме состояния геометрическое место точек конца затвердевания бинарных сплавов с различным содержанием компонентов. Составляющая структурная – часть сплава (однофазная или многофазная), имеющая характерную (однообразную) структуру и отделенная от остальных частей сплава поверхностями раздела. Состав фазовый – количественная характеристика содержания в материале различных фаз. Состав химический – количественная характеристика содержания в материале химических элементов. Строение – совокупность устойчивых связей вещества, обеспечивающих его целостность и тождественность самому себе, т.е. сохранение основных свойств. Точки фигуративные – точки на диаграмме состояния, определяющие фазовый и химический состав системы при заданной температуре. Фаза – термодинамически равновесное состояние вещества, характеризующееся агрегатным состоянием, атомным (молекулярным) составом и строением, а также отделенное пространственными границами от других возможных равновесных состояний (фаз) того же вещества. Эвтектика – структурная составляющая сплава, представляющая собой механическую смесь фаз, образующуюся при одновременной кристаллизации двух (или более) фаз из расплава. Эвтектоид – структурная составляющая сплава, представляющая собой механическую смесь фаз, образующуюся при одновременной вторичной кристаллизации двух (или более) фаз из твердого раствора Практическое занятие №2 Основы теории Общие сведения Основными компонентами сталей и чугунов являются железо и углерод. Железо – металл серого цвета. Атомный номер 26, атомная масса 55,85. Температура плавления железа 1539°С. Железо имеет две полиморфные модификации: α -железо, существующее при температуре ниже 910°С; γ-железо, существующее в интервале температур 910– 1392°С; оно парамагнитно. Кристаллическая решетка α-железа объемно-центрированная кубическая с периодом решетки 0,286 нм. До температуры 768°С железо ферромагнитно. Температуру 768°С, соответствующую переходу α-железа из ферромагнитного состояния в парамагнитное, называют точкой Кюри. Кристаллическая решетка γ-железа гранецентрированная кубическая. Углерод – неметаллический элемент, атомный номер 6, плотность 2,5 г/см3, температура плавления 3500°С. Углерод растворим в железе в жидком и твердом состоянии, а также может быть в виде химического соединения – цементита, а в высокоуглеродистых сплавах – в виде графита.
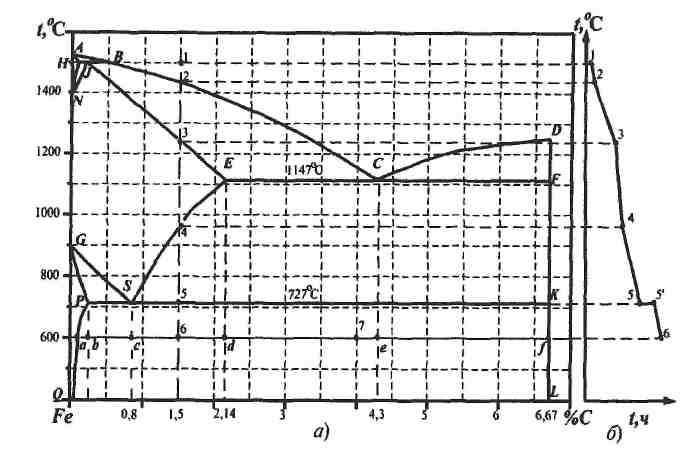
Рис. 9. Диаграмма состояния «железо – углерод»: 1 – метастабильная система; 2 – стабильная система
Углерод может находиться в равновесии с жидкой фазой и с твердыми растворами на основе железа в виде цементита (мета-стабильное равновесие) или графита (стабильное равновесие) в зависимости от внешних условий. Это обстоятельство определяет два варианта диаграммы состояния «железо – углерод» (рис.9). Большее практическое значение имеет метастабильная диаграмма состояния. С помощью этой диаграммы объясняют не только превращения, происходящие в сталях и белых чугунах. Она является основой для выбора оптимальных режимов термообработки железоуглеродистых сплавов. Наряду с основными компонентами в этих сплавах имеются постоянные технологические примеси, которые могут оказывать существенное влияние на их свойства и формирование структуры. В системе Fe – Fe3C различают следующие фазы: жидкий раствор, твердые растворы – феррит и аустенит, а также цементит (в том числе первичный, вторичный и третичный). К структурным составляющим в системе Fe – Fe3C, наряду с перечисленными выше фазами, относятся ледебурит и перлит. 1.2. Анализ фазового состава диаграммы состояния «железо – цементит» Рассмотрим области диаграммы состояния «железо – цементит», которые отвечают равновесным состояниям сплавов системы, и основные фазовые превращения. Однофазные области диаграммы состояния Fe – Fe3C: • жидкая фаза L – расплавы выше линии ликвидуса ABCD; • феррит Ф: высокотемпературная область – левее линии AHN; низкотемпературная область – левее линии GPQ; • аустенит А – область ограничена линией NJESG; • цементит Ц– вертикальная линия DFKL. В двухфазных областях в равновесии находятся: • жидкий раствор и кристаллы феррита (АВН); • кристаллы феррита и аустенита (HJN и GSP); • жидкий раствор и кристаллы аустенита (JBCE); • жидкий раствор и цементит (CDF); • кристаллы аустенита и цементита (SECFK); • кристаллы феррита и цементита (QPSKL). Трехфазным равновесным состояниям сплавов отвечают горизонтальные линии на диаграмме состояния: • при t = 1499°C (линия HJB) в сплавах с концентрацией углерода от 0,1 до 0,51% происходит перитектическое превращение в результате взаимодействия кристаллов феррита с жидким раствором: L(B)+ Ф(Н) → A(J) - аустенит; (1) • при t– 1147°С (линия ECF) в сплавах с концентрацией углерода от 2,14 до 6,67% происходит эвтектическое превращение: L(c) → A(E) + Ц – ледебурит; (2) • при t = 727°С (линия PSK) в сплавах системы с концентрацией углерода более 0,02% происходит эвтектоидное превращение, заключающееся в распаде аустенита на дисперсную механическую смесь чередующихся пластинок феррита и цементита: A{S) → Ф(р)+ Ц – перлит. (3) Составы и количества фаз в системе «железо – цементит» можно определить на коноде с помощью правила отрезков. Структурный качественный и количественный состав сплавов определяется также с помощью коноды, однако ее концы должны быть ограничены линиями соответствующих структурных составляющих.
1.3. Анализ структурного состава Формирование структур в сплавах можно изучить, анализируя по диаграмме процессы, происходящие в них при охлаждении или нагревании. Рассмотрим области диаграммы, которые отвечают равновесным состояниям сплавов системы. В процессе эвтектического превращения жидкий раствор затвердевает в виде ледебурита. Во всех сплавах системы с концентрацией углерода более 0,02% при температуре 727°С (линия PSK) происходит эвтектоидное превращение, причиной которого является полиморфное превращение Fe → Feα В результате эвтектоидного превращения происходит распад аустенита, приводящий к образованию перлита. Цементит может образовываться из жидкой и твердой фаз при различных температурах. Цементит, выделяющийся за счет изменения растворимости при понижении температуры из жидкой фазы, называют первичным (Ц1), из аустенита – вторичным (Ц2), а из феррита – третичным (Ц3). Проследим за формированием структуры сталей с содержанием углерода 1,5% при их медленном охлаждении, начиная с температуры 1600°С. Критические точки, соответствующие температурам превращений, показаны на фигуративных линиях рис. 10.
Рис. 10. Схема для изучения превращений, происходящих в стали с содержанием углерода 1,5% при медленном охлаждении: а – диаграмма состояния; б – кривая кристаллизации сплава Схема структур и состав фаз, а также структурных составляющих для рассматриваемого случая приведены в таблице 2. До температуры 1450°С (точка 1) заэвтектоидная сталь с 1,5% углерода находится в жидком состоянии. При t= 1450°C начинается процесс кристаллизации. В интервале температур 1450 – 1250°С (точки 2, 3) в сплаве сосуществуют две фазы: жидкий раствор и аустенит. В интервале температур 1250 – 950°С (точки 3, 4) сплав охлаждается, не претерпевая никаких превращений; состав сплава представлен аустенитом. При охлаждении сплава ниже 950°С (точка 4) аустенит с концентрацией углерода 1,5% становится пересыщенным. Избыточный углерод из зерен аустенита диффундирует к их границам и здесь выделяется в виде цементита вторичного. Концентрация углерода в аустените при охлаждении сплава от 950 до 727°С (точки 4, 5) изменяется согласно линии ES от точки 4 к точке S:
Таблица 2. Схема структур и состав фаз, а также структурных составляющих для структурного анализа диаграммы состояния Fe – Fe3C (заэвтектоидная сталь; 1,5% С)
При температуре 727°С (точка 5 ) в сплаве происходит эвтектоидное превращение, в результате которого образуется перлит. Ниже температуры 727°С растворимость углерода в феррите уменьшается (линия PQ). В связи с этим избыточный углерод из феррита выделяется в виде цементита третичного (ЦIII) (точки 5, 6). В качестве примера рассмотрим расчет весового количества структурных составляющих и фаз с помощью правила отрезков в заэвтектоидной стали с 1,5% углерода при 600°С. Содержания структурных составляющих определяются последовательно по мере их образования в процессе охлаждения сплава с применением правила отрезков для двух сосуществующих фаз или структурных составляющих по коноде abcbdef. Величину отрезков будем измерять в процентах углерода. Считаем, что концентрация в точке а 0,01% углерода. Определим фазовый состав в точке 6:
Количество структурных составляющих в точке 6:
Учитывая некоторые особенности в использовании коноды для области диаграммы, где находятся три структурные составляющие, рассмотрим расчет для такого случая на примере точки 7 (содержание углерода 4% при температуре 600°С):
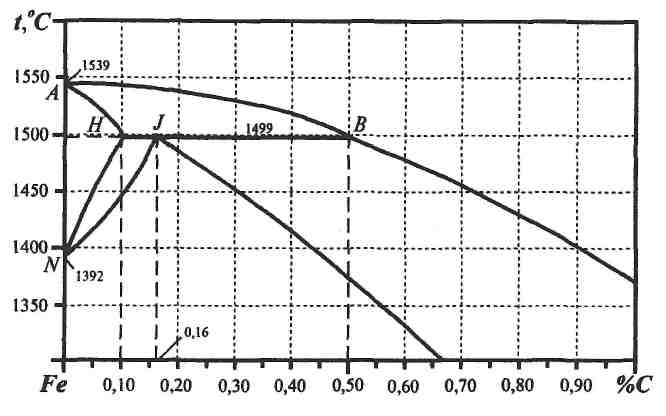
Практическая часть 2.1. Порядок выполнения анализа диаграммы состояния «железо – цементит» 2.1.1.Вычертить диаграмму состояния Fe – Fe3C с указанием температур превращений и концентраций углерода для характерных точек. 2.1.2.Указать фазы и структурные составляющие в различных областях диаграммы. 2.1.3.Определить составы и весовое количество (%) фаз и структурных составляющих при температурах для варианта, указанного преподавателем. При выполнении расчетных задач в перитектической области диаграммы использовать данные по фрагменту этой диаграммы, представленные на рис. 11.
Рис. 11. Фрагмент (высокотемпературная область) диаграммы «железо–углерод»
2.2. Примерный перечень вариантов индивидуальных заданий представлен в таблице 3.
Таблица 3. Индивидуальные задания по анализу диаграммы состояния Fe-C.
3. Термины и определения. Аустенит – твердый раствор внедрения углерода в γ-железе. (предельная растворимость углерода в γ-железе – 2,14%). Ледебурит – структурная составляющая (эвтектика) железоуглеродистых сплавов, главным образом чугунов, представляющая собой механическую смесь кристаллов аустенита и цементита, образующихся в сплавах, содержащих от 2,0 до 6,67% углерода. Перлит – структурная составляющая (эвтектоид) железоуглеродистых сплавов, представляющая собой механическую смесь чередующихся пластинок феррита и цементита, образующихся при распаде аустенита во всех сплавах системы с концентрацией углерода более 0,02% при t = 727°С. Сталь – железоуглеродистый сплав, содержащий 0,02–2,14% углерода. По содержанию углерода и наличию структурных составляющих различают: доэвтектоидные (углерода 0,02–0,83%), эвтектоидные (углерода 0,83%), заэвтектоидные (углерода 0,83– 2,14%) стали. Феррит – твердый раствор внедрения углерода в а-железе. Различают низкотемпературный α-феррит с растворимостью углерода до 0,02 % и высокотемпературный 5-феррит с предельной растворимостью углерода 0,1%. Цементит Fe3C – химическое соединение железа с углеродом (карбид железа) с концентрацией углерода 6,67%. Чугун – железоуглеродистый сплав, содержащий более 2,14% углерода. По содержанию углерода и наличию структурных составляющих различают чугуны: доэвтектические (углерода 2,14–4,3%), эвтектические (углерода 4,3%) и заэвтектические чугуны (углерода 4,3–6,67%). Чугуны белые – чугуны, кристаллизующиеся подобно углеродистым сталям по метастабильной диаграмме состояния Fe – Fe3C (углерод находится в химически связанном состоянии в виде цементита; имеет белый блестящий излом). Практическое занятие №3 Основы теории 1.1 Н агрев при термообработке. Условия нагрева определяются в зависимости от нагревательных устройств. Ими могут быть нагревательные печи топливные или электрические, соляные ванны или ванны с расплавленным металлом. Нагрев может осуществляться также пропусканием через изделие электрического тока или индукционный нагрев токами промышленной или высокой частоты. С точки зрения производительности нагрев необходимо осуществлять с максимальной скоростью. Форсированный нагрев уменьшает также окалинообразование, обезуглероживание стали, рост аустенитного зерна. Однако при этом необходимо учесть возникающий перепад температуры по сечению изделия, вследствие чего в металле возникают термические напряжения, которые могут усиливаться фазовыми напряжениями, если фазовые превращения в разных сечениях протекают в разное время. Если растягивающие внутренние напряжения превысят σт или σ в. стали, то возможно, коробление или образование трещин. Допускаемая скорость нагрева может быть тем выше, чем менее легирована сталь, однороднее ее макро- и микроструктура, проще конфигурация изделия и равномернее подвод тепла к нему. Время выдержки в печи при термической обработке деталей зависит от формы и размеров изделия. Ориентировочные нормы нагрева стали приведены в таблице 4. Таблица 4. Ориентировочные нормы нагрева стали при термической обработке в лабораторных электрических печах
На практике для изделий из углеродистых машиностроительных сталей выбирают скорость нагрева в печах 0,8... 1 мин на 1 мм сечения (толщины пластины, диаметра цилиндра). При нагреве в соляных ваннах время нагрева уменьшается в 2 раза, в расплавленном - свинце — в 3 - 4 раза. Скорость нагрева легированных сталей уменьшается на 25 - 40%. Условия нагрева при массовом производстве отрабатываются опытным путем. Практическая часть Термической обработке Время нагрева деталей включает два этапа. Первый этап - от начала нагрева до достижения в камере печи заданной температуры садки – τ1. По мере достижения в печи заданного значения температуры начинает работать терморегулятор, поддерживая ее неизменной. В течение второго этапа нагрев деталей осуществляется при постоянной температуре печи – τ2. τ = τ 1 + τ2 , где τ – общее время нагрева деталей, мин.
τ1 = G – масса деталей, кг с – средняя удельная теплоемкость, дж/кг · с tзад. – заданная температура, 0С tнач. – первоначальная температура, 0С qn – тепловой поток, Вт/м2 · 103 Fизд. – тепловоспринимающая поверхность деталей. Рпечи - мощность печи, кВт Рпот. – мощность тепловых потерь печи, кВт. τ2 = z – удельное время нагрева, мин/см s – толщина нагреваемого металла, см. Порядок выполнения работы 1. Получить индивидуальное задание. 2. Проанализировав условия задачи (таблица 6), выполнить расчёт времени нагрева детали при ТО по методике, указанной в пункте 2.1. 3. Записать отчёт о работе.
Пример выполнения задания Вэлектрической камерной печи мощностью 25 кВт/ч производится нагрев шести стальных брусков размерами 700х100х100 мм до 8600 С. Бруски укладываются в печь в один ряд, вплотную, нагрев – двухсторонний. Температура печи 9000 С; С = 0,67 · 103 Дж/кг · с; мощность холостого хода 5 кВт/ч. Рассчитать время нагрева детали для ТО. Расчет: Fизд. = 2 · 0,7 · 6 · 0,1 = 0,84 м2 Gизд. = 7,8 · 0,7 · 0,1 · 0,1 · 6 = 0,328 т = 328 кг qn = τ1 = 8070С – (tзад.- tнач.) – температура на первом этапе нагрева (определяется дополнительными расчетами). τ2 = 9,4 – удельное время нагрева для низколегированных сталей. Общее время нагрева деталей τ = τ 1 + τ2 = 2,46 +0,25 = 2,71 часа. Исходные данные для выполнения индивидуального задания Практическое занятие №4 Теоретические основы Нормализация стали. При нормализации сталь нагревают выше температуры AС3 или AС1на З0-50°С, рис. 15а. После выравнивания температуры по всему сечению детали охлаждаются на спокойном воздухе. Таким образом, по режиму нормализация является промежуточной операцией между отжигом и закалкой. Основной целью нормализации является получение мелкозернистой однородной структуры; устранение цементитной сетки в структуре заэвтектоидной стали; частично снятие внутренних напряжений и наклепа; для улучшения штампуемости и обрабатываемости резанием. Нормализация иногда является также предварительной операцией перед окончательной термической обработкой. Низкоуглеродистая сталь после нормализации имеет мелкозернистую структуру феррита и перлита. Поэтому нормализация этих сталей обычно используется вместо отжига с фазовой перекристаллизацией как более экономичная термическая обработка.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 537; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.149.244 (0.013 с.) |


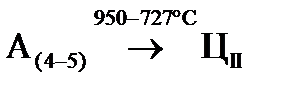








 , где
, где , где
, где , где
, где · 103 = 23800 Вт/м2
· 103 = 23800 Вт/м2 = 2,46 ч
= 2,46 ч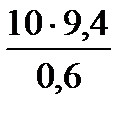 = 15,7 мин=0,25 ч
= 15,7 мин=0,25 ч


