Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическое действие на сталь нагревающей среды.Содержание книги
Поиск на нашем сайте
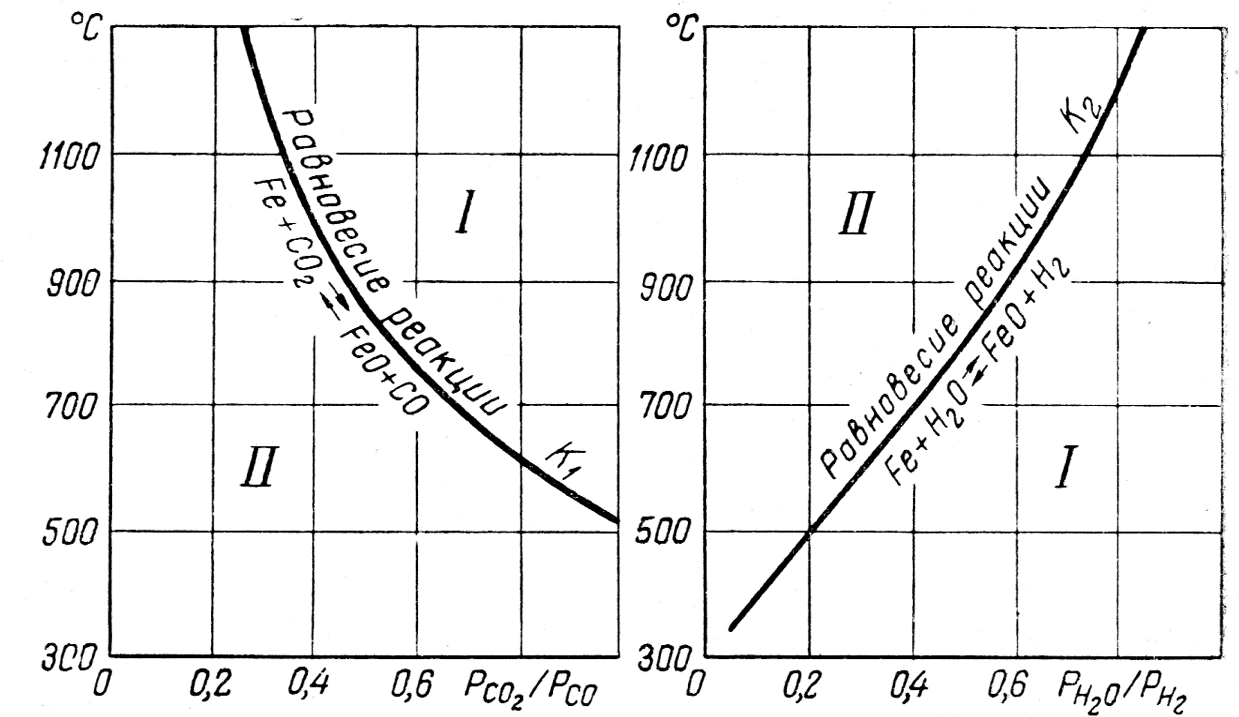
В большинстве случаев нагрев изделий осуществляется в печах с газовой средой. Составляющие газовой среды могут оказывать на сталь различное воздействие: а) окисляющее [О2, СО2, Н2О (пар)]; б) восстанавливающее (СО, Н2, СН4); в) обезуглероживающее (О2, Н2, СО2, Н2О); г) науглероживающее (СО, СН4); д) нейтральное (N2, инертные газы, вакуум). Окисление с образованием окалины Fе2Оз на поверхности детали препятствует получению высокой и равномерной твердости при закалке, приводит к изменению размеров изделий, требует увеличения допусков на механическую обработку и введения трудоемких и вредных операций очистки. Наиболее типичные реакции окисления стали: Н2О+Fе = FеО+Н2 (1) СО2+Fе = FеО+СО. (2) Направление хода этих реакций определяется отношением парциального давления газов-окислителей к парциальному давлению газов-восстановителей. Это отношение называется константой равновесия (К).Для реакций (1) и (2): К(1)=PH2O\PH2; K(2)=PCO2\PCO Равновесие реакции (1) и (2) имеет место при минимальном значении термодинамического потенциала G. Между К и Gсуществует зависимость LgK= ΔG\4,575T. При К>К1или К>К2наблюдается окисление стали. На рис. 19 приведены теоретические кривые равновесия реакций (1) и (2) в зависимости от температуры.
а) б) Рис 13. Теоретическая кривая равновесия реакции окисления железа углекислым газом (а) и водяным паром (б): I – область окисления, II – область восстановления. По данным графиков, представленных на рис. 13, установлено, что для большинства конструкционных сталей при нагреве до t ≈1000°С среда является окислительной, когда CO2\CO≥0,4 H2O\H2≥0,7. Необходимо контролировать состав нагревательной среды. На практике могут возникнуть подобные задачи: Задача № 1. Углеродистая сталь подвергалась нагреву при t=700 °С в газовой среде, имеющей PCO2\PCO=0,5. Будет ли достигнута защита металла от окисления? Задача № 2. В качестве защитной среды для малоуглеродистой листовой стали с 0,05% С при 950 °С использовался газ, для которого P2 CO2\PCO2=20. Листы после отжига не имели окалины, однако при холодной штамповке у выштамповок обнаружился массовый брак по трещинам. В чем причина брака? Для предотвращения окисления можно использовать газовые смеси, в которых отношение окисляющих компонентов к газам-восстановителям при данной температуре может изменяться в широких пределах. Важно только, чтобы значения К были меньше значений К1 и К2, рис. 13.
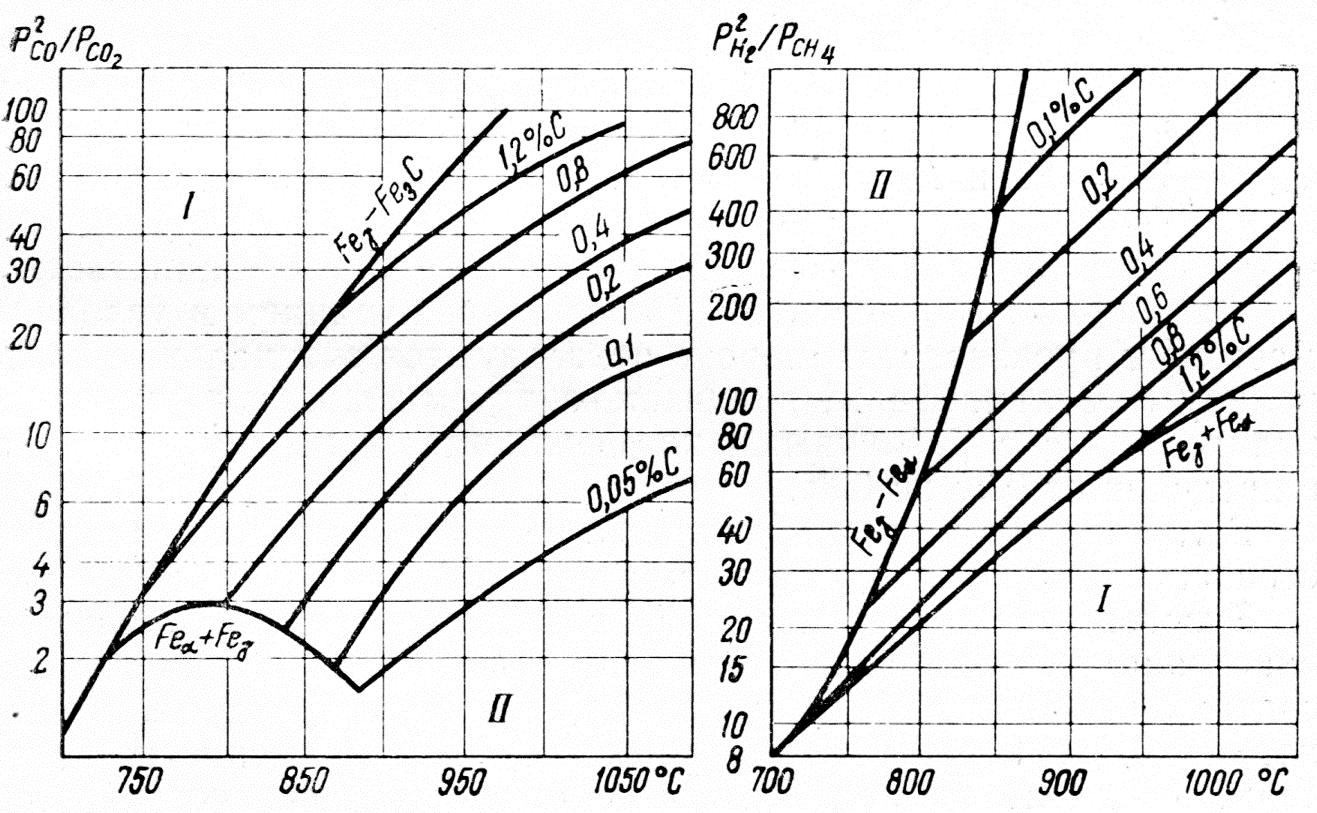
Весьма большее значение имеет изменение содержания углерода в поверхностных слоях при нагреве стали. Обезуглероживание (выгорание углерода в поверхностном слое металла) способствует появлению мягких участков при закалке и возникновению растягивающих напряжений в поверхностном слое, резко снижающих усталостную прочность деталей. Ниже приводится несколько типичных реакций обезуглероживания 2Н2+Fе4(С) = Fе+СН4, (1) Н2О+Fе3С = Н2+СО+ЗFе, (2) СО2+Fе3С = 2СО+ЗFе. (3) На рис. 14 представлены теоретические кривые равновесия реакции обезуглероживания углекислым газом и водородом. Если подбор (и регулирование) газовой среды, предотвращающей окисление, не представляет значительных трудностей, то значительно сложнее обстоит дело с подбором и регулированием состава атмосфер, предназначенных для предотвращения обезуглероживания или же нежелательного науглероживания. Константы равновесия при заданной температуре имеют точные значения, определяемые диаграммой равновесия (рис. 14). Так, согласно рис. 14, уменьшение содержания углерода в стали с 0,4% С при 1000 °С будет предотвращено только когдаK1=P2CO2\PCO2=27 и K2=P2H2\PCH4=400При отклонении от этих значений сталь будет обезуглероживаться или науглероживаться.
а) б) Рис.14. Теоретические кривые равновесия реакции обезуглероживания стали углекислым газом (а) и водородом (б): I –область науглероживания; II – область обезуглероживания. Для борьбы с окислением и обезуглероживанием в условиях массового производства широко используются специальные контролируемые атмосферы, получаемые путем сжигания углеводородных газов с различными коэффициентами избытка воздуха в пределах от 0,25 до 0,95. В таблице 5 приведены данные о некоторых наиболее распространенных контролируемых атмосферах. Таблица 5. Характеристики печной атмосферы.
*По точке росы определяется количество воды в атмосфере воды. Экзотермическая атмосфера используется для борьбы с окислением поверхности, однако от обезуглероживания сталей, содержащих более 0,2% углерода, эта атмосфера не предохраняет. Для борьбы с обезуглероживанием применяется эндотермическая атмосфера. Как было отмечено выше, состав этой атмосферы должен регулироваться весьма точно. Для этого используется автоматическое регулирование количества паров воды в атмосфере, определяемое по точке росы, или содержание СО2. Эндотермическая атмосфера применяется не только для защиты металла от обезуглероживания и окисления, но и для проведения химико-термической обработки стали в газовой среде. Практическая часть
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 703; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.56.125 (0.009 с.) |