Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анализ диаграмм фазового равновесияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Анализ диаграмм фазового равновесия начинается с установления принадлежности диаграммы состояния к одному из пяти описанных выше типов (см. рис. 1). При этом следует иметь в виду, что наличие одной или нескольких эвтектических точек на диаграмме свидетельствует о принадлежности к эвтектическим диаграммам только при отсутствии сингулярных точек. В противном случае мы имеем диаграммы состояния с химическими соединениями. Для выполнения фазового анализа по заданной диаграмме состояния необходимо разделить ее на части, каждая из которых должна быть похожа на типовые диаграммы. Затем нужно определить все фазы системы и многофазные области на диаграмме состояния. После этого рассматриваются превращения при кристаллизации жидкой фазы и превращения в твердом состоянии. Например, диаграмму состояния системы Ag – Сu (см. рис. 5, б) можно разделить на шесть областей. Две из них являются областями твердых растворов аир. Остальные относятся к однофазным (например, расплав на диаграмме находится выше линии ликвидуса) или двухфазным областям. Состав твердых растворов определяется, как правило, в точке максимальной растворимости. Для этого из найденной точки опускается перпендикуляр на ось абсцисс, и в соответствии с заданным масштабом определяется соотношение между компонентами.
Практическая часть 2.1. Порядок выполнения работы Для выполнения задания необходимо: 2.1.1. Получить у преподавателя номер варианта и выписать индивидуальное задание из таблицы 1. 2.1.2. Начертить в масштабе анализируемую диаграмму состояния. 2.1.3. Дать буквенные обозначения всем линиям диаграммы состояния. 2.1.4. Определить, к какому типу (см. рис. 1) относится диаграмма состояния. 2.1.5. Провести фазовый и структурный анализы диаграммы состояния. 2.1.6. Рассчитать составы твердых растворов (при их наличии в системе). 2.1.7. Написать практическую часть отчета о работе в соответствии с вышеуказанными пунктами задания. Таблица 1. Перечень диаграмм состояния двойных систем для выполнения индивидуального задания.
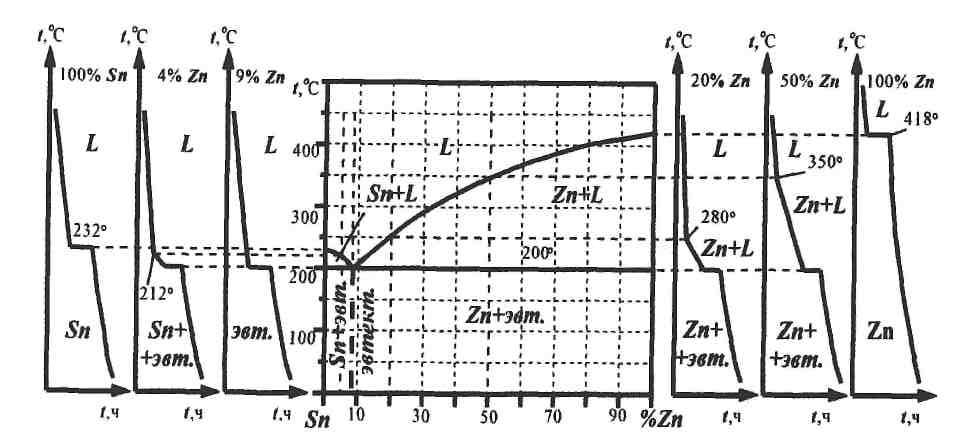
Примечание. Для всех вариантов соответствующие диаграммы состояний приведены в приложении I. 2.2 Пример построения диаграммы состояния (система «олово – цинк») Для построения диаграммы методом термического анализа необходимо получить кривые охлаждения чистых металлов и ряда их сплавов. В данном случае проведено исследование чистых металлов олова и цинка, а также их сплавов: доэвтектического (4% Zn + 96% Sn), эвтектического (9% Zn + 91% Sn) и двух сплавов заэвтектических (20% Zn + 80% Sn и 50% Zn + 50% Sn) составов (рис. 8). После проведения термического анализа указанных металлов и сплавов для получения критических точек необходимо построить кривые их кристаллизации. По полученным данным строится диаграмма состояния системы Sn – Zn (см. рис.8). Для теоретической проверки правильности построения диаграммы состояния и анализа кривых охлаждения пользуются правилом фаз: С=К-Ф+1, где С – число степеней свободы, т.е. число изменяющихся внешних и внутренних факторов (температура, концентрация, давление); К– число компонентов; Ф – число фаз. Под числом степеней свободы системы понимается число независимых переменных факторов, которое можно изменить при сохранении числа фаз в системе. В качестве примера рассмотрим кристаллизацию сплавов системы Sn – Zn (см. рис.8). Кристаллизация сплава эвтектического состава этой системы (9% Zn + 91% Sn) происходит при постоянной температуре, и в системе сосуществуют три фазы (жидкость + кристаллы цинка + + кристаллы олова). В соответствии с правилом фаз число степеней свободы равно нулю: С=К-Ф+ 1 = 2-3+ 1 = 0, т.е. система безвариантна, и любое изменение температуры или концентрации вызовет нарушение равновесия. Наличие горизонтального участка на кривой охлаждения (см. рис. 8) сплава показывает постоянство температуры. Температура остается постоянной до полного исчезновения одной из фаз, т.е. жидкости. Кристаллизация до- и заэвтектических сплавов происходит в интервале температур между линиями ликвидуса и солидуса. При этом сплавы состоят из кристаллов олова и цинка в зависимости от состава жидкости, т.е. Ф–2. Число степеней свободы равно единице: С= 2 – 2+1 = 1. Здесь система одновариантна, что позволяет, сохраняя равновесие сплава, произвольно менять либо температуру (зависимой переменной будет концентрация), либо концентрацию (зависимой переменной будет температура). В системе олово – цинк при комнатной температуре существуют две твердые фазы: кристаллы олова и цинка. Взаимная растворимость этих металлов в твердом состоянии незначительна, поэтому олово и цинк практически считают не растворяющимися друг в друге. По составу и структуре сплавы данной системы делятся на доэвтектические, эвтектические и заэвтектические.
Рис. 8 Кривые охлаждения сплавов системы Sn-Zn и ее диаграмма состояния Структура доэвтектических сплавов (менее 9% Zn) состоит из избыточных кристаллов олова и эвтектики. Микроструктура эвтектического сплава, содержащего 9% Zn и 91% Sn, состоит из механической смеси мелких зерен двух фаз – олова и цинка. Структура заэвтектических сплавов (более 9% Zn) состоит из избыточных кристаллов цинка и эвтектики. 3. Термины и определения. Диаграмма фазового равновесия (диаграмма состояния) – графическое изображение соотношения между параметрами состояния (температурой, давлением, составом) термодинамически равновесной системы, т.е. фазового состояния любого сплава изучаемой системы компонент в зависимости от его концентрации. Компонент – составная часть, в данном случае химический элемент, образующий сплав. Конода – горизонтальный отрезок, концы которого ограничены равновесными сосуществующими фазами и содержанием в них компонентов; характеризует состав фаз, находящихся в равновесии. Ликвидус – геометрическое место точек начала затвердевания бинарных сплавов с различным содержанием компонентов на диаграмме состояния. Линии фигуративных точек – вертикальные линии на диаграмме состояния, соответствующие определенному химическому составу сплава. Линия предельной растворимости – линия на диаграмме состояния бинарных сплавов, характеризующая изменение растворимости компонента с изменением температуры. Перитектика – структурная составляющая сплава, представляющая собой механическую смесь фаз, образующуюся за счет ранее выделившейся твердой фазы и закристаллизовавшейся жидкой части сплава определенного состава. Раствор твердый – однофазный в твердом состоянии сплав, в котором соотношение компонент может быть переменным и один из компонентов (растворитель) сохраняет свою кристаллическую решетку, а атомы другого (или других) компонента располагаются в решетке этого компонента, изменяя ее размеры (периоды решетки). Система (гетерогенная) – макроскопически неоднородная термодинамическая система, состоящая из различных по физическим свойствам или химическому составу частей (фаз). Соединение химическое – фаза, кристаллическая решетка которой отличается от решеток компонентов, ее образующих. В химическом соединении всегда сохраняется простое кратное соотношение компонентов АmВn, где m и n – простые числа. Солидус – на диаграмме состояния геометрическое место точек конца затвердевания бинарных сплавов с различным содержанием компонентов. Составляющая структурная – часть сплава (однофазная или многофазная), имеющая характерную (однообразную) структуру и отделенная от остальных частей сплава поверхностями раздела. Состав фазовый – количественная характеристика содержания в материале различных фаз. Состав химический – количественная характеристика содержания в материале химических элементов. Строение – совокупность устойчивых связей вещества, обеспечивающих его целостность и тождественность самому себе, т.е. сохранение основных свойств. Точки фигуративные – точки на диаграмме состояния, определяющие фазовый и химический состав системы при заданной температуре. Фаза – термодинамически равновесное состояние вещества, характеризующееся агрегатным состоянием, атомным (молекулярным) составом и строением, а также отделенное пространственными границами от других возможных равновесных состояний (фаз) того же вещества. Эвтектика – структурная составляющая сплава, представляющая собой механическую смесь фаз, образующуюся при одновременной кристаллизации двух (или более) фаз из расплава. Эвтектоид – структурная составляющая сплава, представляющая собой механическую смесь фаз, образующуюся при одновременной вторичной кристаллизации двух (или более) фаз из твердого раствора Практическое занятие №2
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 1727; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.008 с.) |