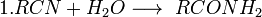Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация и номенклатура , способы получения карбоновых кислот.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. По ИЮПАК,,выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание "овая" и слово "кислота". Например СН3-СН2-СООН - пропановая кислота, СН3-С(СН3)2-СООН - 2,2-диметилпропановая кислота. По рациональной добавляют окончание "карбоновая" и слово "кислота. Например, С5Н9СООН - циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН - трет-бутилкарбоновая кислота. В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот: ароматические алифатические (в том числе предельные и непредельные) алициклические гетероциклические. По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. Окисление спиртов
Окисление альдегидов
Гидролиз тригалогеналканов
Карбоксилирование металлорганических соединений
Гидролиз сложных эфиров
Гидролиз нитрилов
21.Химические свойства придельных одноосновных карбоновых кислот. На примере уксусной кислоты. Нап уравн реакц образование сложного эфира из уксусной кислоты и пропанол2. 1. Диссоциация кислот. Все карбоновые кислоты, подобно неорганическим кислотам, обладают кислыми свойствами, окрашивая лакмус в красный цвет. Это обусловлено диссоциацией кислот: RCOOH <-> RCOO- + Н+ 2. Образование солей. Карбоновые кислоты легко всту пают в реакции с основаниями, основными оксидами и активными металлами: 2RCOOH + Mg = (RCOO)2Mg + Н2 RCOOH + NaOH = RCOONa + H2O 2RCOOH + CaO = (RCOO)2Ca + H2O Соли карбоновых кислот сильно гидролизованы в водном растворе как соли слабых кислот. Минеральные кислоты, как более сильные, вытесняют карбоновые кислоты из их солей: CH3COONa + НСl = СН3СООН + NaCl Карбоновые кислоты устойчивы к действию концентрированных минеральных кислот. Исключение составляет муравьиная кислота, которая под действием концентрированной H2S04 разлагается: HCOOH ---H2SO4---> CO + H2O 4. При действии галогенов на кислоты в присутствии фосфора образуются альфа-галогенозамещенные кислоты: СН3-СН2-СООН + Вг2 -> СН3-СНВr-СООН + НВr 5. При действии восстановителей, таких как LiAlH4, кислоты восстанавливаются до первичных спиртов:
R-СООН -> R-СН2ОН + Н20 6. Насыщенные кислоты с нормальной углеродной цепью окисляются трудно. Кислоты с третичным атомом углерода дают при окислении оксикислоты: (СН3)2СН-СООН -> (СН3)2С(ОН)СООН Образование сложного эфира. 1. CH3-CН(ОН)-СН3 + СН3COOH = CH3-COO-CH(CH3)2
22. Химические свойства предельных двухосновных карбоновых кислот. На примере щавелевой кислоты. Написать уравнение образования сложного эфира из щавелевой кислоты и пропанол2. Двухосновные карбоновые кислоты (или дикарбоновые кислоты) — это карбоновые кислоты, содержащие две карбоксильные группы —COOH, с общей формулой HOOC—R—COOH, где R — любой двухвалентный органический радикал. Щавелевая кислота широко распространяется в природе в виде кальциевых солей
Дикарбоновые кислоты проявляют те же химические свойства, что и монокарбоновые — эти свойства обусловлены наличием карбоксильной группы: диссоциация в водных растворах первая стадия (Ka1): НOOC—Х—СООН → НOOC—Х—СОО− + Н+ вторая стадия (Ka2): НOOC—Х—СОО− → −OОC—Х—СОО− + Н+ образования сложного эфира из щавелевой кислоты и пропанол2. 1.НООС-СООН + СН3-СН(ОН)-СН3 (H2SO4) = HOOC-COO-CH(CH3)2 + H2O 2. HOOC-COO-CH(CH3)2+ СН3-СН(ОН)-СН3 (H2SO4) = (H3C)2CH-OOC-COO-CH(CH3)2 + H2O
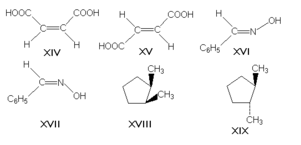
23. Геометрическая (цис и транс-) изомерия на примере фумаровой кислоты. Написать уравнение реакции образования сложного эфира из фумаровой кислоты и пропанол- 2. π-диастереомеры, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX)
Образование сложного эфира НООС-СН=СН-СООН + СН3-СН(СН3)-ОН ------> СН3-СН(СН3)-ООС-СН=СН-СООН + Н2О, моноизопропилфумарат. СН3-СН(СН3)-ООС-СН=СН-СООН + СН3-СН(СН3)-ОН------> СН3-СН(СН3)-ООС-СН=СН-СОО-СН(СН3)-СН3 + Н2О, диизопропилфумарат.
|
|||||
|
Последнее изменение этой страницы: 2016-06-24; просмотров: 1140; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.79.193 (0.007 с.) |