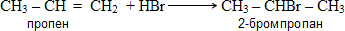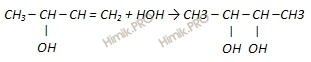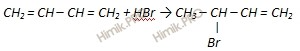Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изомерия ароматических углеводородов. Нап формулы 2 и 3 –замещенных бензола.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для ароматических углеводородов характерна изомерия углеродного скелета. Например, формуле C8H10 соответствует четыре изомера: орто-ксилол мета-ксилол пара-ксилол
Этилбензол
Двузамещенные производные бензола существуют в виде трех изомеров, называемых орто-, мета- и пара-производными
Число изомеров для трехзамещенных равно трем C6H5CH2CH2CH3 – пропилбензол C6H5CH(CH3)2 изопропилбензол
6. Химические св-ва придельных углеводородов. Илюстр эти свойства на примере уравн реакций метана. Какое практ применеие имеют продукты реакций. Алканы, или парафины — алифатические предельные углеводороды, в молекулах которых атомы углерода связаны между собой простой s-связью. Химические свойства алканов 1. Реакции замещения - Галогенирование (стадийно) CH4 + Cl2 hν → CH3Cl(хлорметан) + HCl (1 стадия); метан CH3Cl + Cl2 hν → CH2Cl2 (дихлорметан)+ HCl (2 ст); СH2Cl2 + Cl2 hν → CHCl3 (трихлорметан)+ HCl (3 ст); CHCl3 + Cl2 hν → CCl4 (хлорметан)+ HCl (4 ст). 2. Реакции горения (горят светлым не коптящим пламенем)CnH2n+2 + O2 t→ nCO2 + (n+1)H2O 3. Реакции разложения а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:C10H22 → C5H12 + C5H10 б) Пиролиз при температуре 1000°С разрываются все связи, продукты – С (сажа) и Н2: СH4 1000°С→ C + 2H2 Применение: Использование в качестве топлива – в котельных установках, Вазелин используется в медицине, парфюмерии, косметике, Метан используется для производства шин и краски. 7. Химические св-ва этиленовых углеводородов. Илюстр эти свойства на примере уравн реакций этана. Правило Марковникова. Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул. Галогенирование: CH2=CH2 + Cl2 → CH2Cl—CH2Cl Происходит обесцвечивание бромной воды. Это качественная реакция на непредельные соединения. Гидрирование: CH2=CH2 + H - H → CH3 - CH3 (под действием Ni) Гидрогалогенирование: CH2=CH2 + HBr → CH3 - CH2Br Гидратация: CH2=CH2 + HOH → CH3CH2OH (под действием катализатора) Этилен легко окисляется Горение:C2H4 + 3O2 → 2CO2 + 2H2O Полимеризация (получение полиэтилена): nCH2=CH2 → (-CH2-CH2-)n Правило Марковникова:
В реакциях присоединения молекул сложных веществ типа НХ (Х – F, Cl, Br, I, OH- и др.) к несимметричным алкенам атом водорода присоединяется к более гидрированному атому углерода при двойной связи.
Химические св-ва ацетиленовых углеводородов. Напишите соответствующие уравнения реакций. Какая реакция называется реакцией Кучерова. 1) Гидрирование CH3–CєCH(пропин) ––t°,Pd;H2•® CH3–CH=CH2(пропен) ––t°,Pd;H2® CH3–CH2–CH3(пропан) 2) Галогенирование. HCєCH ––Br2® CHBr=CHBr(1,2- дибромэтен) ––Br2® CHBr2–CHBr2(1,1,2,2- тетрабромэтан) 3) Гидрогалогенирование. CH3–CєCH ––HBr® CH3–CBr=CH2(2- бромпропен -1) ––HBr® CH3–CBr2–CH3(2,2- дибромпропан) 4) Гидратация (реакция Кучерова). Присоединение воды осуществляется в присутствии сульфата ртути. Эту реакцию открыл и исследовал в 1881 году М.Г.Кучеров. Присоединение воды идет по правилу Марковникова, образующийся при этом неустойчивый спирт с гидроксильной группой при двойной связи (так называемый, енол) изомеризуется в более стабильное карбонильное соединение - кетон. C2H5–CєCH + H2O ––HgSO4® [C2H5– C=CH2](енол) ® C2H5– I ø OH C–CH3(метилэтилкетон) II O
Химич свойства диеновых углеводородов с сопряжёнными связями. Напишите характерные реакции для бутадиена – 1.3. реакции галогенирования и гидрогалогенирования сопряженных диенов.
2.Дегидротация спиртов. СН3-СН(внизОН)-СН2-СН2(вниз ОН)---(Н+)(-2Н2О)--- СН2=СН-СН=СН2 СН3-С(вниз ОН)(СН3)-СН2-СН2(внизОН)-- (Н+)(-2Н2О)--- СН2=С(вниз СН3)-СН=СН2 Получение Бутадиен получают по реакции Лебедева пропусканием этилового спирта через катализатор: 2CH3CH2OH → C4H6 + 2H2O + H2 дегидрогенизация бутана на алюмохромовых катализаторах: CH3-CH2—CH2—CH3 → CH2=CH—CH=CH2 + 2Н2 взаимодействия бутадиена-1,3 с водой
В ходе реакции получили бутандиол-2,3. взаимодействия бутадиена-1,3 с бромоводородом
В ходе реакции получили 2,3-дибромбутан.
|
|||||
|
Последнее изменение этой страницы: 2016-06-24; просмотров: 1767; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.27.154 (0.007 с.) |



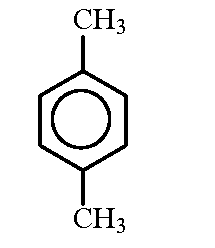


 1-Метил-3-этилбензол
1-Метил-3-этилбензол