Жалындардың негізгі типтерін сипаттаңыз.
1. Жану туралы жалпы түсінік. Жанудың кейбір ұғымдарын сипаттаңыз.
Жану – адамзаттың негізгі энергия көзі. Ядролық энергияның пайда болуымен басқа энергия көздерінің рөлі біршама азайды, бірақ жану өзінің жетекші маңызын жоғалтқанша әлі көптеген жылдар өтеді.
Оттың табиғаты туралы ойлар тас ғасырының аңыздары сияқты көнеден белгілі. Олар көптеген діндердің дамуында, сондай-ақ химияның ғылым ретінде пайда болуында маңызды рөл атқарды. Бұған қарамастан, жану процесінің ядролық және фотосинтез процестерінен айырмашылығы әлі толық зерттелмеген.
Жану – бұл 1 миллион жылдан астам уақыттан бері адамзат пайдаланып келе жатқан ең көне технология. Қазіргі уақытта энергияның 90%-ы жану процесінде өндіріледі, демек, оны зерттеу өзекті мәселе болып табылады.
Бұрын жану процесін зерттеу, негізінен, химиялық реакцияда бөлінетін жылуды толық қамтитын гидродинамиканы зерттеуге бағытталған болатын. Қазіргі уақытта бұл процестердің әрқайсысы жеке дамуда, ал өлшеулерді жүргізу техникасы мен жалынды зерттеу жанудың көптеген мәселелерін шешетіндей деңгейге жетті.
Жанғыш зат пен тотықтырғыш (әдетте ауа) жану барысында араласып, жанады.
Жану процестерін сандық бейнелеу үшін бізге негізгі ұғымдар мен анықтамалар қажет болады.
Химиялық реакцияны өзара соқтығысатын атомдардың алмасу немесе тарату процесі ретінде қарастыруға болады. Мәселен, химиялық реакцияның жүруі барысында атомдар сақталады. Басқа жағынан молекулалар сақталмайды. Атомдар мен молекулалар мөлшерін зат мөлшері немесе заттың мольдік мөлшері терминімен өрнектеуге болады. Заттың 1 молі 6,023*10(23) бөлшекке сәйкес келеді. NA=6,023*10(23) моль(-1) саны Авогадро саны деп аталады.
ωi массалық үлесі дегеніміз-ол i компонентінің mi массасының қоспаның m=∑mi толық массасына қатынасы (ωi=mi/m). i компонентінің мольдік массасы (немесе мольдік салмағы) Mi (г/моль)-ол берілген компоненттің 1 молінің массасы. Осылайша атомаралық көміртегі, молекулалық сутегі, оттегі және метан үшін мыналарды аламыз:
Mc=12 г/моль, Мн2=2 г/моль, Мо2=32 г/моль, Мсн4=16г/моль.Көбінесе мольдік және массалық үлестер пайыздық түрде көрсетіледі.Тығыздықтар жүйенің өлшеміне тәуелсіз. Мұндай айнымалылар қарқынды деп аталады және жүйенің көлеміне сәйкес келетін экстенсивті айныалылардың қатынасы ретінде анықталады. Қарқынды айнымалылар мысалына мыналарды жатқызуға болады:
Массалық тығыздық(тығыздық): p=m/v (кг/м3)
Мольдік тығыздық(концентрация): с=n/v (моль/м3)
Орташа мольдік масса мына қатынас арқылы өрнектеледі:p/c=m/n=M.
Химияда химиялық компоненттің концентрациясы көбінесе тік жақша ішінді химиялық элементтің символымен белгіленеді: (Сн2о=[H2O])
Жанғыш зат пен тотықтырғыш (әдетте ауа) жану барысында араласып, жанады. Жану алдында бұл компоненттердің араласуына немесе араласу мен жану бір мезгілде жүзеге асуына байланысты жалындар алдын ала араласқан және алдын ала араласпаған болып бөлінеді. Бұл категориялардың жалындары жанғыш қоспа ағынына байланысты ламинарлы және турбулентті болып бөлінеді де, Рейнольдс санымен анықталады:
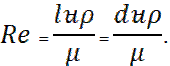
l – жүйенің сипаттамалық өлшемі, цилиндр жағдайында d шамасымен белгіленеді; 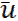 – газдың орташа жылдамдығы; – газдың орташа жылдамдығы; 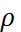 – тығыздық;μ – тұтқырлық. – тығыздық;μ – тұтқырлық.
Алдын ала араласқан қоспаның ламинарлы жалындарында отын мен тотықтырғыш жануға дейін араласады да, ағын ламинарлы болады.
Мұндай жалындарға жазық ламинарлы жалын мен бунзен жанарғысының жалыны (отынға кедей қоспалар үшін) мысал бола алады.
Егер отын (көмірсутек) мен тотықтырғыш (оттегі) бір-біріне толық жұмсалып, толық жану өнімдері (көміртек диоксиді мен су) түзілсе, алдын ала араласқан қоспа жалыны стехиометриялық (толық жану) деп аталады. Егер отын артық қалса, онда қоспа отынға бай, егер тотықтырғыш артық қалатын болса, қоспа отынға кедей болады.
|