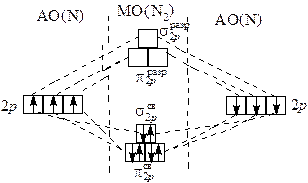Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Водородные соединения халькогеновСодержание книги
Поиск на нашем сайте
В ряду H2O – H2S – H2Se – H2Te восстановительные свойства соединений и кислотные свойства водных растворов увеличиваются, а термическая устойчивость падает. Соли селеноводородной кислоты (селениды) и теллуроводородной кислоты (теллуриды) по свойствам близки к сульфидам. Кислородные соединения элементов подгруппы селена. Селен и теллур образуют оксиды типа ЭО2 и ЭО3. SeО2 и ТeО2 образуются при сгорании селена и теллура на воздухе, при обжиге селенидов и теллуридов, при сжигании водородных соединений этих элементов: 2СdSe + 3О2 = 2СdО + 2SeО2; 2Н2Те + 3О2 = 2Н2О + 2ТeО2. SeО2 и ТeО2 – бесцветные кристаллические вещества, проявляющие свойства кислотных оксидов. Им соответствуют селенистая (H2SeО3) и теллуристая (H2ТeО3) кислоты. Сравнительная характеристика оксидов ЭО2
В воде растворяется диоксид селена, ТeО2 непосредственно с водой не взаимодействует: SeО2 + Н2О = H2SeО3. Селенистая кислота выделена в свободном состоянии, теллуристая кислота получается косвенным путем, в свободном виде не получена и существует только в водных растворах в виде полимера ТeО2 · n Н2О. В ряду SО2 – SeО2 – ТeО2 – РоО2 происходит ослабление кислотных свойств и нарастание основных свойств. Так ТeО2 можно растворить в растворе щелочи, как и SО2, SeО2: ТeО2 + 2KОН =K2ТеО3 + Н2О. РоО2 со щелочами взаимодействует только при сплавлении, но взаимодействует с кислотами, проявляя основные свойства: РоО2 + 2KОН РоО2 + 2H2SО4 = Ро(SО4) 2 + 2Н2О. В ряду H2SО3 ( В химических реакциях соединения S+4 преимущественно проявляют восстановительные свойства, соединения Sе+4 и Те+4 проявляют главным образом окислительные свойства, восстанавливаясь до свободного состояния: 2SО2 + SeО2 + 2H 2О = 2H2SО4 + Se; К2ТеО3 + 2SО2 + Н2О = H2SО4 + К2SО4 + Тe. Восстановительные свойства селенистая и теллуристая кислоты проявляют лишь при взаимодействии с сильными окислителями: 3H2SeО3 + НС1О3 = 3H2SeО4 + НС1. H2SeО4 при нагревании не разлагается с образованием SeО3, его получают при взаимодействии селената натрия с избытком оксида серы (VI): Nа2SeО4 + SО3 = Nа2SО4 + SeО3. Оксид селена (VI) – бесцветное кристаллическое вещество, хорошо растворяется в воде с образованием селеновой кислоты: SeО3 + Н2О = H2SeО4. Селеновая и теллуровая кислоты – бесцветные кристаллические вещества, хорошо растворимые в воде. Свободная теллуровая кислота обычно выделяется в виде кристаллогидрата H2ТeО4 · 2Н2О или H6ТeО6. В ортотеллуровой кислоте атомы водорода могут частично или полностью замещаться атомами металлов (K6ТeО6). Селеновая кислота по силе близка к серной кислоте, водный раствор теллуровой кислоты проявляет свойства слабой кислоты. В ряду H2SО4 – H2SeО4 – H2ТeО4 (H6ТeО6) кислотные свойства уменьшаются. Селеновая кислота H2SeО4 – белое кристаллическое вещество, энергично притягивающее влагу. Селеновая кислота менее устойчива, чем серная кислота, поэтому она более сильный окислитель, чем H2SО4. Селеновая кислота обугливает органические вещества. Окислительные свойства теллуровой кислоты слабее, чем у серной кислоты. Концентрированная серная кислота не окисляет концентрированную соляную кислоту, селеновая кислота окисляют НС1 с выделением свободного хлора: H2SeО4 + 2НС1 = H2SeО3 + С12 + Н2О. За счет выделения атомарного хлора смесь селеновой и соляной кислот растворяет золото и платину. Кроме того, золото не растворяется в горячей серной кислоте, горячая безводная селеновая кислота растворяет его: 2Au + 6H2SeО4 = Au2(SeO4)3 + 3H2SeО3 + 3Н2О. Повышение стабильности и уменьшение окислительной способности оксосоединений при переходе от Se (VI) к Te (VI)обусловлено особенностями строения и увеличением прочности связи Te–O в октаэдрических ионах TeO H6ТeО6 2ТeО3 ТeО3 – порошок желтого цвета, не растворяется в воде, а также в разбавленных растворах кислот и щелочей. Триоксид теллура растворяется только в концентрированных водных растворах щелочей: ТeО3 + 2NаОН = Nа2ТeО4 + Н2О.
Биогенная роль р -элементов VI A группы Кислород относится к числу важнейших элементов, составляющих основу живых веществ. Окисление кислородом питательных веществ (углеводов, белков, жиров) служит источником энергии, необходимой для живых организмов. Недостатком кислорода в высокогорных условиях вызывается, например, «горная болезнь». Уменьшение парциального давления на 1/3 вызывает кислородное голодание, а на 2/3 – смертельный исход. Сера – биогенный химический элемент, т. е. постоянная составная часть организма человека. Большая ее часть в виде органических кислот входит в состав аминокислот. Содержится в волосах, коже, костях, хрящах, желчи, в нервной ткани и других клетках организма. Входит в состав инсулина и участвует в его образовании. В живых организмах сера, входящая в состав аминокислот, окисляется, конечным продуктом окисления преимущественно являются сульфаты, но могут образовываться свободная сера, тиосульфаты и политионовые кислоты. Образующаяся в организме серная кислота участвует в обезвреживании ядовитых соединений (фенола, крезола, индола), вырабатываемых в кишечнике из аминокислот, а также связывает многие чужеродные для организма соединения (например, лекарственные препараты), которые затем выводятся из организма. Наиболее ядовитым из соединений серы является сероводород, вызывающий смерть от остановки дыхания. ПДК его в воздухе 10 мг/м3, в смеси с углеводородами токсичность резко возрастает, ПДК – 3 мг/м3. В результате тепловой обработки продуктов питания (фасоль, птица), в состав которых входят белки, содержащие серу, происходит их разрушение с выделением Н2S. Поэтому для консервирования таких продуктов используют металлические банки, покрытые изнутри лаком, чтобы избежать образования сульфида олова. Ядовитыми являются и пары СS2, их высокие концентрации действуют наркотически. SО2 при его содержание в воздухе более чем 0,03–0,05 мг/л вызывает одышку, бронхит, воспаление легких. Аэрозоль Н2SО4 (SО3 + Н2О) более токсичен, чем серная кислота, его раздражающее действие проявляется уже при 1 мг/м3. Н2SО4 при попадании на кожу вызывает тяжелые ожоги и глубокие язвы. Пероксодисульфаты щелочных металлов способствуют появлению аллергических заболеваний.
Применение р -элементов VI А группы и их соединений Кислород применяют в металлургии при производстве чугуна и стали. В смеси с ацетиленом для сварки и резки металлов. Жидкий кислород – составная часть ракетного топлива. Озон как сильный окислитель используют для дезинфекции помещений, обеззараживания воздуха и очистки питьевой воды. Пероксид водорода применяют в ракетной технике, для обработки и травления поверхности металлов, для производства неорганических и органических пероксидов, для обеззараживания сточных вод, в медицине и косметике. Основная масса пероксида водорода идет на отбеливание естественных и искусственных волокон, бумажной массы, для осветления мыл и синтеза синтетических моющих средств. В пищевой промышленности Н2О2 используют для удаления из некоторых продуктов солей сернистой кислоты. Серу применяют для производства серной кислоты, взрывчатых веществ, для вулканизации каучука. Нерастворимые в воде сульфиды имеют разнообразную яркую окраску, поэтому их широко используют в качестве пигментов при производстве красок. Сплавы, полученные в результате прокаливания сульфидов щелочноземельных металлов с добавками флюса (плавиковый шпат, бура) и следами тяжелых металлов, применяют для изготовления светящихся красок. В кожевенной промышленности применяют сульфиды натрия, кальция, бария. В медицине ванны с сульфидом калия применяют для лечения кожных заболеваний. Мелкодисперсная сера – основа мазей, необходимых для лечения грибковых заболеваний. Все сульфамидные препараты – это органические соединения серы. SO2 убивает многие микроорганизмы. Поэтому для уничтожения плесневых грибков им окуривают сырые подвалы, погреба, винные бочки и др. Используют при перевозке и хранении фруктов и ягод. Na2SO4 ∙ 10H2O – глауберова соль (в производстве соды, стекла). 2CaSO4 ∙ H2O – алебастр (лепка, шины при переломах). MgSO4 ∙ 7H2O – (горькая соль) в медицине слабительное. CuSO4 ∙ 5H2O – для борьбы с вредителями сельского хозяйства. FeSO4 ∙ 7H2O – для очистки воды, консервирования (предохранение древесины от гниения). BaSO4 –рентгеноконтрастное вещество в медицине. ZnSO4 ∙ 7H2O – цинковый купорос – протрава при крашении тканей.
Основная масса производимого теллура потребляется металлургией. Добавки теллура к свинцу повышают прочность и коррозионную устойчивость изделий из свинца. Медь и сталь, содержащие теллур, легко обрабатываются резкой. В производстве стекла добавки теллура придают ему коричневый оттенок и увеличивают коэффициент лучепреломления. Селен применяют для изготовления выпрямителей и фотоэлементов. Селен и теллур применяют в полупроводниковой технике. Тема 3. р -элементЫ V А группы V A группа: N (азот), P (фосфор), As (мышьяк), Sb (сурьма) и Bi (висмут). Полные электронные формулы атомов: 7N: 1 s 2 2 s 22 р 3; 15P: 1 s 22 s 22 р 6 3 s 23 р 3; 33As: 1 s 22 s 22 р 63 s 23 р 6 4 s 24 р 3; 51Sb: 1 s 22 s 22 р 63 s 23 р 63 d 104 s 24 р 64 d 10 5 s 2 5 р 3; 83Bi: 1 s 22 s 22 р 63 s 23 р 63 d 104 s 24 р 64 d 104 f 145 s 25 р 65 d 10 6 s 2 6 р 3.
Сокращенная электронная конфигурация … ns 2 np 3. Электронно-графические схемы для азота и фосфора:
Общая характеристика атомов элементов и простых веществ представлена в табл.3.1.
Таблица 3.1 Общая характеристика р -элементов V A группы
Устойчивость соединений в низших степенях окисления падает в группе от азота к висмуту, а устойчивость соединений в степени окисления +5 уменьшается при переходе от фосфора, как к азоту, так и к висмуту. Азот и фосфор ‒ типичные неметаллы, мышьяк проявляет также и металлические свойства, сурьма и висмут ‒ типичные металлы. Из-за отсутствия d -подуровня атом азота не может иметь возбужденного состояния с пятью неспаренными электронами, поэтому его валентность в соединениях не превышает IV. Соединения азота(+5) отличаются по химическим свойствам от аналогичных соединений фосфора и мышьяка. Три неспаренных электрона в основном и пять - в возбуждённом состояниях позволяют Р, As, Sb и Bi проявлять валентности III и V. Благодаря ns 2-электронной паре и вакантным nd -орбиталям валентность элементов может быть также IV и VI. У сурьмы и висмута в комплексных соединениях в виду больших размеров их атомов валентность может достигать VII и VIII, например, во фторидных комплексах K2[SbF7] и K3[BiF8].
Азот
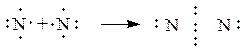
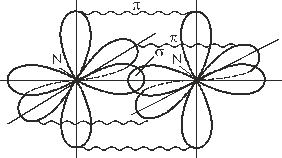
Основная масса азота в природе находится в земной атмосфере (объемная доля простого вещества N2 равна 78%). В связанном виде азот входит в состав белков всех растительных и животных организмов. Редко встречаются минералы азота: чилийская селитра - NaNO3 и индийская селитра - KNO3, которые имеют биогенное происхождение. Физические свойства. При обычных условиях азот – бесцветный газ, без вкуса и запаха, абсолютно безвреден, немного легче воздуха, мало растворим в воде (23 мл в 1 л холодной воды). Газообразный азот состоит из двухатомных молекул N2. Между атомами в молекуле реализуется тройная связь (рис. 3.1):
Энергетическая диаграмма молекулярных орбиталей представлена на рис. 3.2. Как видно из рисунка, кратность связи в молекуле N2 равна 3.
Наличие вакантных p-разрыхляющих орбиталей определяет p-акцепторную способность азота, проявляющуюся в образовании комплексных соединений, например, [Ru(N2)(NH3)5]2+. В этих комплексах молекула N2 является лигандом. Неподеленная пара электронов азота образует донорно-акцепторную s-связь, а заполненные d -орбитали иона металла участвуют в образовании p-дативной связи с вовлечением p-разрыхляющих орбиталей молекулы азота. Структура твердого азота построена из двухатомных молекул, связанных слабыми силами межмолекулярного взаимодействия. Химические свойства азота. Прочность молекулы N2 (энергия химической связи составляет 945 кДж/моль), ее неполярность, близость энтальпии ионизации (1402 кДж/моль) к энтальпии ионизации аргона объясняют химическую инертность азота по отношению ко многим веществам. Азот непосредственно не взаимодействует с галогенами и серой (галогениды и сульфиды могут быть получены косвенным путем), с водой, кислотами и щелочами. В обычных условиях N2 используют для создания инертной атмосферы вместо более дорогих благородных газов. Азот проявляет очень слабые восстановительные и окислительные свойства. При комнатной температуре он реагирует только с литием: 6Li + N2 = 2Li3N. В случае инициирования реакций нагреванием, электрическим разрядом или ионизирующими излучениями, а также в присутствии катализаторов азот взаимодействует с сильными окислителями и восстановителями. С металлами, неметаллами при нагревании: 3Mg + N2 2B + N2 Под действием электрического разряда азот реагирует с кислородом: O2 + N2 ⇄ 2NO. С водородом при температуре около 500ºС и давлении 10 – 100 МПа в присутствии катализатора – металлического железа: 3H2 + N2 ⇄ 2NH3. В промышленности ч истый азот наряду с кислородом получают фракционной перегонкой жидкого воздуха. На первой стадии из воздуха удаляют частицы пыли, пары воды и углекислый газ. Затем воздух сжижают, охлаждая его и сжимая до высоких давлений. Далее фракционной перегонкой жидкого воздуха разделяют азот, кислород и аргон. Первым отгоняется азот (t кип = –195,79ºС), затем кислород (t кип = –182,95ºС).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 263; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.217.1 (0.014 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

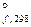 , кДж/моль
, кДж/моль
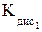
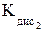
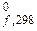 , кДж/моль
, кДж/моль
 K2РоО3 + Н2О;
K2РоО3 + Н2О;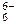 по сравнению со связью Se–O в тетраэдрах SeО
по сравнению со связью Se–O в тетраэдрах SeО 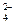 . Атом теллура по сравнению в атомом селена имеет больший радиус, для него характерно координационное число 6. Увеличение числа координируемых атомов кислорода приводит к росту числа электронов на связывающих молекулярных орбиталях и, соответственно, к повышению прочности связи. При нагревании ортотеллуровая кислота разлагается:
. Атом теллура по сравнению в атомом селена имеет больший радиус, для него характерно координационное число 6. Увеличение числа координируемых атомов кислорода приводит к росту числа электронов на связывающих молекулярных орбиталях и, соответственно, к повышению прочности связи. При нагревании ортотеллуровая кислота разлагается: 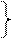 KCr(SO4)2 ∙ 12H2O
KCr(SO4)2 ∙ 12H2O
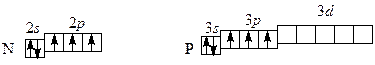
 Увеличение
Увеличение Увеличение
Увеличение Уменьшение
Уменьшение