
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика элементов
Электронная конфигурация хрома:
Атом Cr имеет 6 неспаренных электронов: пять d -электронов на пяти d -орбиталях и 1 электрон на внешней s -орбитали. У атомов хрома и молибдена наблюдается «проскок» одного электрона с ns - на Таблица 11.1 Некоторые свойства d -элементов VI группы
Как и в других подгруппах d -элементов, в ряду Cr – Mo – W увеличивается энергия ионизации, следовательно, химическая активность металлов понижается. Вследствие лантаноидного сжатия атомные радиусы Мо и W близки, поэтому молибден и вольфрам по свойствам ближе друг к другу, чем к хрому. В соединениях хром, молибден, вольфрам проявляют все степени окисления от +2 до +6. Для хрома состояние +3 наиболее устойчиво. При переходе от хрома к вольфраму наблюдается тенденция к возрастанию устойчивости соединений с высшей степенью окислениия +6. Рост степени окисления сопровождается усилением кислотных и окислительных свойств и увеличением ковалентного характера связей. Cr, Mo, W – это очень твердые и тугоплавкие металлы. Вольфрам – самый тугоплавкий из металлов, он – лучший материал для нитей и спиралей ламп накаливания. Высокая температура плавления свидетельствует о заметном ковалентном вкладе в химическую связь. У d -элементов этот ковалентный вклад обусловлен наличием неспаренных электронов на d -подуровне. Наличие 6 неспаренных электронов в кристаллах d -элементов 6 группы обеспечивает максимальный ковалентный вклад и самые высокие t пл среди металлов. В природе хром и его аналоги в свободном состоянии не встречаются. Важнейшие минералы: Fe(CrO2)2 – хромит (хромистый железняк); PbCrO4 – крокоит; MoS2 – молибденит (молибденовый блеск); (Fe, Mn)WO4 – вольфрамит; CaWO4 – шеелит. Получение. Хром получают в виде феррохрома (сплава с железом), восстанавливая углем хромистый железняк в электрических печах:
Fe(CrO2)2 + 4C
феррохром Выплавленный феррохром используют для получения нержавеющей стали. Чистый хром можно получить алюмотермическим путем из оксида Cr (III) или восстановлением кремнием в присутствии CaO: Cr2O3 + 2Al 2Cr2O3 + 3Si + 3CаO Cr2O3 получают сплавлением хромистого железняка с содой в присутствии кислорода и последующим восстановлением углем: 4Fe(CrO2)2 + 7O2 + 8Na2CO3 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O; Na2Cr2O7 + 2C В гидрометаллургическом методе молибден извлекают путем флотации из различных руд, в которых содержатся соли молибденовой кислоты, и чаще всего в виде парамолибдата аммония (NH4)6Mo7O24 × 4H2O. Молибден и вольфрам получают восстановлением их оксидов или галогенидов водородом: 4MoS2 + 14O2 = 4MoO3 + 8SO2; MoO3 + 3H2 4FeWO4 + 4Na2CO3 + O2 Na2WO4 + 2HCl ® 2NaCl + H2WO4; H2WO4 WO3 + 3H2 Металлы получают в виде порошков. Их переводят в слиток методом порошковой металлургии: подвергают холодному прессованию под высоким давлением, затем спекают в инертной атмосфере. Металлы высокой степени чистоты получают через карбонилы, которые легко чистят перегонкой и далее разлагают при нагревании: Ме + 6СО Ме(СО)6 Химические свойства. В компактном состоянии хром, молибден и вольфрам устойчивы, но порошки легко сгорают в кислороде при нагревании до 800°С, при этом образуются оксиды в характерных для этих металлов степенях окисления: 4Cr + 3O2 = 2Cr2+3O3; (W) 2Mo + 3O2 = 2Mo+6O3. При комнатной температуре хром, молибден и вольфрам взаимодействуют с фтором, а при нагревании с остальными галогенами: 2Cr + 3Г2 = 2CrГ3 (Г = F, Cl, Br); Cr + I2 = CrI2; (W) Mo + 3F2 = MoF6; 2Mo + 5Cl2 = 2MoCl5; W + 3Cl2 = WCl6. Сплавлением металлов с серой образуются сульфиды, кристаллические вещества переменного состава: 2Cr + 3S (W) Mo + 2S При нагревании хром, молибден, вольфрам соединяются с азотом с образованием нитридов MeN, Me2N и др. (нитриды Мо и W можно получить взаимодействием металла с газообразным аммиаком). С углеродом образуют карбиды Cr3C2, Cr4C, Mo2C, W2C, MoC, WC. Нитриды и карбиды металлов VI В группы – сверхтвердые, тугоплавкие, химически инертные соединения. WC по твердости не уступает алмазу. Все они являются соединениями внедрения. Атомы неметаллов находятся в пустотах кристаллической решетки металлов.
Металлы VI В группы, как и остальные d -элементы, с водородом химически не взаимодействуют. Хром при высоких температурах растворяет водород, образуя твердые растворы внедрения. Молибден и вольфрам водород практически не поглощают. Хром, молибден, вольфрам стоят в ряду напряжений до водорода (хром находится между цинком и железом), однако они являются довольно инертными металлами. Это обусловлено пассивацией – образованием на поверхности тонкой, но плотной оксидной пленки. Наиболее сильно пассивируется хром. При температуре красного каления хром, молибден и вольфрам реагируют с парами воды, образуя оксиды: 2Cr + 3H2O Мо + 2Н2О В непассивном состоянии хром довольно активен и реагирует с кислотами-неокислителями HCl и H2SO4(разб), с образованием соединений Cr2+, поскольку в этих условиях пассивирующая пленка разрушается: Cr + 2HCl = CrCl2 + H2; Cr + H2SO4 = CrSO4 + H2. Кислоты-окислители HNO3, H2SO4(конц) на хром не действуют, а еще больше пассивируют его. Молибден и вольфрам легко растворяются в горячей смеси HNO3 и HF: Mo + 6HNO3 + 8HF = H2[MoF8] + 6NO2 + 6H2O и в расплавах щелочей в присутствии окислителей: W + 3NaNO3 + 2NaOH = Na2WO4 + 3NaNO2 + H2O. Соединения металлов VI В группы. Для всех элементов VI В группы известны кислородные соединения со степенями окисления +6, +4. Хром образует кислородные соединения в степенях окисления +2, +3, поэтому низшие оксиды получены только для хрома. Оксид хрома (II) CrO – основный оксид, черное, тугоплавкое вещество, нерастворимое в воде. CrO реагирует с кислотами: CrO + H2SO4 = CrSO4 + H2O. CrO получают осторожным обезвоживанием Cr(OH)2 в восстановительной атмосфере: Cr(OH)2 = CrO + H2O. Гидроксид Cr (OH)2 – слабое нерастворимое основание коричневого цвета, взаимодействует с кислотами: Cr(OH)2 + 2HCl = CrCl2 + 2H2O. Получают гидроксид действием аммиака или щелочей на соли CrCl2 + 2NaOH = Cr(OH)2¯ + 2NaCl. Соединения Cr (II) являются сильными восстановителями, так как степень окисления +2 для хрома не характерна. Cr(OH)2 легко окисляется кислородом воздуха, а CrO даже при растирании на воздухе окисляется до Cr2O3: 4Cr(OH)2 + O2 + 2H2O = 4Cr(OH)3. Оксид хрома (III) Cr 2 O 3 – самое устойчивое соединение хрома. Cr2O3 – темно-зеленое тугоплавкое вещество. Применяется в качестве абразивного материала (паста ГОИ) и добавки к корунду при выращивании кристаллов рубина. Cr2O3 в компактном состоянии инертен, не растворяется в воде, растворах кислот и щелочей. Амфотерные свойства этот оксид проявляет, взаимодействуя при сплавлении с дисульфатами и щелочами: Cr2O3 + 3K2S2O7 = Cr2(SO4)3 + 3K2SO4; Cr2O3 + 2NaOH В мелкодисперсном состоянии Cr2O3 растворяется в сильных кислотах и щелочах: Cr2O3 + 3H2SO4 = Cr2(SO4)3 + 3H2O. Cr2O3 + 6KOH +3H2O = 2K3[Cr(OH)6] (гексагидроксохромат (III) калия). Оксид хрома (III) п олучают сжиганием мелкораздробленного металла, а также разложением гидроксида хрома (III) или дихромата аммония: (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O. или при восстановлении соединений хрома (VI): K2Cr2O7 + 2C K2Cr2O7 + S Г идроксид Cr(OH)3. Формула Cr(OH)3 условна; соответствующий оксиду хрома (III) гидроксид представляет собой грязно-фиолетовый осадок гидратированного оксида Cr2O3 × n H2O.
Cr(OH)3 – слабый нерастворимый амфотерный гидроксид ( Cr(OH)3 + 3HCl = CrCl3 + 3H2O; Cr(OH)3 + 3KOH = K3[Cr(OH)6]. Гидроксид хрома (III) получают реакцией обмена из солей: Cr2(SO4)3 + 6KOH = 2Cr(OH)3¯ + 3K2SO4. При хранении Cr(ОН)3 его реакционная способность снижается за счет постепенной замены связей Cr–OH на связи Cr–O–Cr. При нагревании Cr(ОН)3 переходит сначала в метагидроксид CrО(ОН), а затем в оксид Cr2O3. Оксиды МеО3 представляют собой твердые кристаллические вещества. МеО3 – типичные кислотные оксиды. CrO 3 – термически неустойчивое красного цвета вещество, разлагается при нагревании: 4CrO3 MoO3 (белый, желтеющий при нагревании), WO3 (лимонно-желтый) – термически устойчивы и испаряются без разложения в виде полимеров (МеО3) n, где n = 2–6. CrO3 жадно впитывает влагу, хорошо растворяется в воде с образованием хромовых кислот Н2Cr n O3 n +1 (n = 1, 2, 3, 4); чем концентрированнее раствор, тем больше степень конденсации:
CrO3 – очень сильный окислитель. МоО3 и WO3 малорастворимы в воде, их кислотный характер проявляется при взаимодействии со щелочами. Могут образовывать полимолибдаты и поливольфраматы. МеО3 легко растворяются в щелочах, образуя соответствующие соли: CrO3 + 2NaOH = Na2CrO4 + Н2О. Оксидам МеО3 соответствуют кислоты H 2 MeO 4. Хромовая кислота H2CrO4 – кислота средней силы, существует только в водных растворах ( Молибденовая H2MoO4 и вольфрамовая H2WO4 кислоты – слабые, малорастворимые кислоты. Из растворов они выделяются в виде гидратов соответствующих оксидов MoO3 × 2H2O, WO3 × 2H2O. Перечисленным кислотам соответствуют соли: хроматы (желтые), дихроматы (оранжевые), молибдаты (бесцветные), вольфраматы (бесцветные). Между хромат- и дихромат-ионами устанавливается равновесие, которое может быть смещено изменением кислотности среды: OH– Cr2O H+ В кислых средах устойчивы дихроматы, в щелочных – хроматы. Благодаря этому из хроматов легко получить дихроматы и наоборот: K2Cr2O7 + 2KOH = 2K2CrO4 + H2O; оранжевый желтый 2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O. желтый оранжевый Хроматы и дихроматы при сильном нагревании разлагаются: 4K2Cr2O7 Поскольку для хрома наиболее характерна степень окисления +3, то соединения хрома (VI) являются сильными окислителями. Дихроматы в кислой среде восстанавливаются до хрома +3:
K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O; Cr2O Взаимодействие ионов Cl– и Cr2O K2Cr2O7 +2НCl = 2KCrO3Cl + H2O. При нагревании смеси K2Cr2O7 и НCl выделяется диоксид-дихлорид хрома: K2Cr2O7 + 6НCl Хроматы в щелочной и нейтральной средах – менее энергичные восстановители. Производные хрома +6 могут быть восстановлены в нейтральной и слабощелочной средах действием только сильных восстановителей: 2K2CrO4 + 3(NH4)2S + 8H2О = 2Cr(OH)3 + 3S +4KOH + 6NH4OH; CrO Соединения, содержащие Mo и W в степени окисления +6, находятся в устойчивом состоянии, поэтому окислительные свойства проявляют лишь при взаимодействии с наиболее сильными восстановителями. Таким образом, при переходе сверху вниз по группе стабилизируются высшие степени окисления. Оксид CrO3 получают по реакции: K2Cr2O7 + H2SO4(конц) = 2CrO3 + K2SO4 + H2O. MoO3 и WO3 получают окислением металла или его соединений кислородом воздуха, а также прокаливанием молибдатов или вольфраматов аммония: 2Mo + 3O2 = 2MoO3; 2WS3+ 9O2 = 2WO3 + 6SO2. H2CrO4 получают растворением CrO3: CrO3 + H2O = H2CrO4. H2MoO4 и H2WO4 получают реакцией обмена из солей: Na2MoO4 + H2SO4 = Na2SO4 + H2MoO4¯. Хроматы получают обжигом на воздухе смеси хромистого железняка с содой или поташем 4Fe(CrO2)2 + 7O2 + 8Na2CO3 Галогениды Мо2+ являются тугоплавкими малорастворимыми кластерами состава Ме6Cl12 или (Мо6Г8)Г4 (Г = Cl, Br, I). Соединения представляют собой многоядерные комплексы с непосредственными связями Ме–Ме. Высшие галогениды в силу высокой доли ковалентности связи MoCl6 + H2O = MoOCl4 + 2HCl. Галогениды образуются при взаимодействии простых веществ: W + 3Cl2 = WCl6; Mo + 3F2 = MoF6. Соли. Соединения, содержащие катион Ме+2 известны только для хрома. Галогениды Cr+2 – твердые кристаллические вещества, неустойчивы, легко окисляются до соединений Cr+3, восстанавливают воду до Н2: 2CrCl2 + 2H2O = 2CrOHCl2 + H2; Сr3+ + е – = Сr2+; Е Окисляются кислородом воздуха: 4CrCl2 + O2 + 4HCl = 4CrCl3 + 2H2O. В водных растворах соединения хрома (III) обладают высокой устойчивостью, поэтому хром (III) образует соли со многими известными кислотами. Ионы хрома (III) в водных растворах существуют в виде гидратных комплексов [Cr(H2O)6]3+. Из растворов соли хрома (III) выделяют в виде кристаллогидратов CrCl3 × 6H2O, Cr(NO3)3 × 9H2O и др. Сульфат хрома (III) с сульфатами щелочных металлов образует двойные соли KCr(SO4)2 × 12H2O – хромкалиевые квасцы, по составу и структуре аналогичные алюмокалиевым квасцам. Растворимы практически все соли хрома (III), кроме CrPO4, CrAsO4. Т.к. соли хрома (III) образованы слабым основанием, в растворе они подвергаются гидролизу: Cr2(SO4)3 + 2H2O ⇄ 2CrOHSO4 + H2SO4;
Cr3+ + H2O ⇄ CrOH2+ + H+; 2KCr(SO4)2 + 2H2O ⇄ 2CrOHSO4 + K2SO4 +H2SO4. Соли хрома (III) с анионами слабых кислот из водных растворов получить нельзя, поскольку протекает совместный гидролиз: Cr2(SO4)3 + 3K2S + 6H2O = 2Cr(OH)3 + 3H2S + 3K2SO4. Под действием окислителей соли хрома (III) в щелочной среде окисляются до хроматов: 2KCrO2 + 3Br2 +8KOH = 2K2CrO4 + 6KBr + 4H2O. Для хрома (VI), молибдена (VI), вольфрама (VI) характерно образование пероксосоединений:
Этой реакцией пользуются для обнаружения малых количеств хрома. Графическая формула пероксида хрома CrO5:
Из солей двухвалентного хрома относительно устойчивы сульфат CrSO4 (при кристаллизации из раствора образует хромовый купорос CrSO4 × 7H2O), цианидный комплекс K4[Cr(CN)6] – аналог желтой кровяной соли. Комплексные соединения. Хром и его аналоги образуют многочисленные комплексные соединения с лигандами: NH3, F–, Cl–, OH–, H2O, CN–. Во всех соединениях хром имеет координационное число 6, d 2 sp 3-гибридизацию, которой соответствует октаэдрическое расположение лигандов. 3 d -электроны иона Cr+3 в октаэдрическом поле занимают три d -орбитали с низкой энергией, поэтому комплексы Cr (III) прочны. Для аквакомплексов хрома (III) характерна гидратная изомерия. Гидратная (сольватная) изомерия заключается в различном распределении молекул растворителя между внутренней и внешней сферами комплексного соединения, в различном характере химической связи молекул воды с комплексообразователем. Примером гидратной изомерии является существование трех изомерных гидратов хлорида хрома (III) с общей формулой CrCl3 × 6H2O. Первый изомер, [Cr(H2O)6]Cl3 – хлорид гексааквахрома (III) представляет собой кристаллы серо-сиреневого цвета, которые при растворении в воде образуют фиолетовый раствор. Такую окраску раствору придают катионы [Cr(H2O)6]3+. Из раствора под действием ионов Ag+ осаждаются все три хлорид-аниона: [Cr(H2O)6]Cl3 + 3AgNO3 = [Cr(H2O)6](NO3)3 + 3AgCl. Второй изомер – [Cr(H2O)5Cl]Cl2 × H2O, моногидрат хлорида хлоропентааквахрома (III), придает раствору голубовато-зеленый цвет, а ионы Ag+ осаждают только два хлорид-иона: [Cr(H2O)5Cl]Cl2 + 2AgNO3 = [Cr(H2O)5Cl](NO3)2 + 2AgCl. Наконец, третий изомер – [Cr(H2O)4Cl2]Cl × 2H2O, дигидрат хлорида дихлоротетрааквахрома (III), окрашивает раствор в темно-зеленый цвет, а ионы Ag+ осаждают из его раствора только один хлорид-ион: [Cr(H2O)4Cl2]Cl + AgNO3 = [Cr(H2O)4Cl2]NO3 + AgCl. При высушивании два последних изомера теряют внешнесферную воду. Можно добиться постепенного взаимного перехода изомеров, изменяя pH либо температуру раствора. При этом введение избытка кислоты и охлаждение способствуют образованию первого изомера, а нагревание – переходу ко второму и третьему изомеру. изомерия аммиачных аквакомплексов хрома: CrCl3 + 6NH3 = [Cr(NH3)6]Cl3 – хлорид гексаамминхрома(III); желтый и изомерный ему [Cr(NH3)5Cl]Cl2 – хлорид хлоропентаамминхрома(III). красный Для молибдена и вольфрама характерны комплексы с фтором и кислородом: 2KF + WF6 = K2[WF8]. Cr, Mo, W образуют гексакарбонилы Ме(СО)6, бесцветные твердые вещества. Их получают восстановительным карбонилированием галогенидов металлов: CrCl3 + Al + 6CO = Cr(CO)6 + AlCl3. Разложением карбонилов при нагревании получают тонкие порошки чистых металлов: Cr(CO)6 = Cr + 6CO. В ряде свойств соединений Э+6 наблюдается заметная аналогия со свойствами S+6, и эта аналогия иногда выражается сильнее, чем у S+6 с Se+6 и Те+6. Так, в ряду H2SO4‒H2CrO4‒H2MoO4‒H2WO4 сила кислот монотонно снижается, в то время как в ряду H2SO4‒H2SeO4‒H6TeO6 две первые кислоты приблизительно одинаково сильные, а третья – слабая. Хроматы по растворимости сходны с сульфатами: SO3 и CrO3 легко реагируют с водой, образуя кислоты; SO2Cl2 и CrO2Cl2– жидкости; SF6, MoF6, WF6 легколетучи и т. д. Вместе с тем, соединения Cr+6, Мо+6, W+6 и S+6 обнаруживают и различия. Гексафториды металлов VI Б группы, например МоF6, в отличие от SF6, очень реакционноспособны. Гидролиз SO2Cl2 протекает до конца, a CrO2Cl2 гидролизуется обратимо: SO2Cl2 + 2H2O = H2SO4 + 2НCl, Δ G CrO2Cl2 + 2H2O ⇄ Н2CrO4 + 2НCl, Δ G Биогенная роль d -элементов VI Б группы Хром ‒ микроэлемент, необходимый для нормального развития и функционирования человеческого организма. Установлено, что в биохимических процессах принимает участие только трехвалентный хром. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови. Хром является составной частью низкомолекулярного комплекса – фактора толерантности к глюкозе, который облегчает взаимодействие клеточных рецепторов с инсулином, уменьшая тем самым потребность в нем организма. Фактор толерантности усиливает действие инсулина во всех метаболических процессах с его участием. Кроме того, хром принимает участие в регуляции обмена холестерина и является активатором некоторых ферментов. Содержание хрома в организме взрослого человека составляет около 6 г. Физиологическая потребность человека в этом элементе сильно зависит от характера питания (например, сильно возрастает при избытке сахара в рационе). По разным оценкам норма ежедневного поступления хрома в организм составляет 20–300 мкг. Концентрация элемента в растительной пище на порядок меньше его концентрации в тканях млекопитающих. Особенно высоко содержание хрома в пивных дрожжах, кроме того, в заметных количествах он есть в мясе, печени, бобовых, цельном зерне. Дефицит хрома в организме может вызвать состояние, подобное диабету, способствовать развитию атеросклероза и нарушению высшей нервной деятельности. Растворимые соединения шестивалентного хрома опасны, обладают аллергическим, мутагенным и канцерогенным действием. В биохимических процессах молибден участвует в высших степенях окисления (+5, +6). Mo создает устойчивые оксокомплексы (например, [МоО3(ОН)2]), входит в состав ферментов, обеспечивающих перенос оксогрупп. Избыточное содержание молибдена в пище нарушает метаболизм Са2+ и РО Молибден является важнейшим микроэлементом растений, так как биологически активные вещества с его участием обеспечивают мягкую фиксацию азота: превращают в аммиак или азотсодержащие продукты. По сравнению с другими промышленно важными металлами молибден малотоксичен.
|
|||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 35; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.190.102 (0.128 с.) |

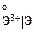 , В
, В
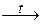 Fe + 2Cr + 4CO.
Fe + 2Cr + 4CO.
 Ме(СО)6;
Ме(СО)6; =
=

 H2O Н2СrO4 Н2Cr2O7 Н2Cr3О10
H2O Н2СrO4 Н2Cr2O7 Н2Cr3О10 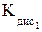 = 1,82 × 10–1;
= 1,82 × 10–1; 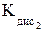 = 3,24 × 10–7).
= 3,24 × 10–7). + H2O ⇄ 2CrO42– + 2H+.
+ H2O ⇄ 2CrO42– + 2H+. 4K2CrO4 + 2Cr2O3 + 3O2.
4K2CrO4 + 2Cr2O3 + 3O2. + 14H+ +6 е – = 2Cr3+ + 7H2O; E
+ 14H+ +6 е – = 2Cr3+ + 7H2O; E  = 1,33 B.
= 1,33 B.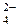 + 4H2O + 3 e – = Cr(OH)3 + 5OH–; E
+ 4H2O + 3 e – = Cr(OH)3 + 5OH–; E  K2Cr2O7 + 2H2O2 + H2SO4 2CrO5 + K2SO4 + 3H2O.
K2Cr2O7 + 2H2O2 + H2SO4 2CrO5 + K2SO4 + 3H2O.
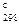 = –385 кДж;
= –385 кДж;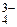 , вызывая снижение прочности костей – остеопорозы.
, вызывая снижение прочности костей – остеопорозы.


