
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Щелочных металлов и их соединений
K, Na применяют в качестве теплоносителя в атомных реакторах и в авиационных двигателях; в качестве катализаторов в органическом синтезе; в уличных люминисцентных светильниках; для получения пероксида натрия Na2O2 и надпероксида калия KO2, которые используются в подводных лодках и космических кораблях для получения кислорода: 2Na2O2 + 2CO2 = 2Na2CO3 + O2. KОН, NaОН, K2CO3, Na2CO3 применяют для производства бумаги, мыла, стекла, искусственных волокон, для очистки нефтепроводов, в щелочных аккумуляторах. NaНCO3 применяют в медицине, кулинарии, в огнетушителях. NaCl – в качестве сырья для получения Na, NaОН, Cl2, HCl; в пищевой промышленности, в медицине. KCl, NaNO3, KNO3, K2SO4 – в качестве удобрений.
Тема 8. ВОДОРОД
Водород – первый элемент периодической системы элементов. В природе водород встречается в виде трех изотопов, которые имеют индивидуальные названия:
Катион H+ (и ядро) самого распространенного изотопа водорода протия 1H – протон. Атом водорода состоит из ядра и одного электрона. Электронная конфигурация 1 s 1. Электронно-графическая схема:
На s -орбитали атома 1 неспаренный электрон. Водород можно отнести к элементам I А группы, так как у водорода, как и у щелочных металлов, на последнем энергетическом уровне находится один электрон, и для него наиболее характерна степень окисления +1. Но водород можно отнести и к элементам VII А группы, так как до завершения энергетического уровня ему не хватает одного электрона и он так же, как и галогены, может проявлять степень окисления, равную –1. Как и галогены, водород – газообразное вещество, молекулы состоят из двух атомов. Энергия ионизации водорода (1312,05 кДж/моль) близка энергии ионизации хлора (1251,19 кДж/моль). Для щелочных металлов значения энергии ионизации ниже (для натрия 495,8 кДж/моль). Значение относительной электроотрицательности водорода (2,20) ‒ промежуточное между значениями относительной электроотрицательности металлов и неметаллов. Поэтому водород в химических реакциях может выступать как роли в окислителя (с менее электроотрицательными элементами), так и в роли восстановителя (с более электроотрицательными элементами). Однако окислительные свойства водорода из-за небольшого значения энергии сродства к электрону (72,769 кДж/моль) выражены менее ярко, чем восстановительные. Поэтому образование гидрид-иона Н– наблюдается только при взаимодействии водорода с наиболее активными металлами – щелочными и щелочноземельными.
Распространение в природе. Водород – самый распространенный элемент во Вселенной (»92% всех атомов). Массовая доля водорода в земной коре составляет 1% – это десятый по распространенности элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна»52%). Поэтому значение водорода в химических процессах, происходящих на Земле, очень велико. Практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005% по объему). Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50%. Простое вещество водород (H2) – легкий газ без цвета, вкуса и запаха. Устойчив к нагреванию до 2000°С. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен, плохо растворим в воде, растворим в этаноле и ряде металлов: Fe, Ni, Pt, Pd. Основные физические характеристики H2: плотность 0,0000899 г/см³ (при 273K (0°C)); температура плавления –259,2°С; температура кипения –252,6°С; D (по воздуху) 0,069; растворимость в воде 0,0019 г /л (в 100объемах H2O Химические свойства водорода. Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия. Поэтому при обычных температурах водород реагирует только с очень активными металлами и с единственным неметаллом – фтором. С большинством металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении.
Восстановительные свойства водород проявляет: – с галогенами, образуя галогеноводороды. С фтором реакция протекает со взрывом в темноте и при любой температуре: F2 + H2 = 2HF. С хлором реакция протекает при поджигании или при облучении ультрафиолетом: Cl2 + H2 – с кислородом при поджигании или внесении в водородно-кислородную смесь платинового (Pt) катализатора: О2 + 2Н2 – с азотом при повышенном давлении и нагревании в присутствии катализаротов (реакция обратима):
N2 + 3H2 2NH3; – с серой при нагревании (реакция обратима): S + H2 – с сажей взаимодействует при сильном нагревании: C + 2H2 Окислительные свойства водород проявляет только с активными (щелочными и щелочноземельными) металлами: 2Na + H2 Ca + Н2 Гидриды – солеобразные, твердые вещества. Они являются сильными восстановителями, так как степень окисления –1 менее характерна для водорода. Гидриды разлагаются водой и кислотами: CaH2 + 2H2O = Ca(OH)2 + 2H2↑; CaH2 + 2HCl = CaCl2 + 2H2↑. В реакциях со сложными веществами для водорода характерны восстановительные свойства. При высокой температуре водород может восстанавливать большинство оксидов металлов: CuO + Н2 Fe2O3 + 3H2 Водород может восстановить из оксидов только те металлы, которые в электрохимическом ряду расположены правее Zn. Восстанавливает некоторые соли и бинарные соединения неметаллов: SiCl4 + 2H2 2FeCl3(р-р) + H2(газ) = 2FeCl2(р-р) + 2HCl(р-р); CuCl2(р-р) + H2(газ) = Cu↓ + 2HCl(р-р). Молекулярный водород применяется в органическом синтезе для восстановления органических соединений (реакции гидрирования):
СH2═CH2 + H2 СH3─CH3. Качественная реакция на водород – сгорание с «хлопком» собранного в пробирку H2. Получение водорода
Бинарные соединения водорода можно классифицировать на группы: – молекулярные соединения водорода (B2H6, CH4, H2O, HF). Молекулярные соединения водорода подразделяют на электронодефицитные (B2H6), электроноизбыточные (H2O, HF) и соединения, в которых все валентные электроны принимают участие в образовании связей (CH4). Кислотно-основные свойства водородных соединений неметаллов изменяются по периоду и группе следующим образом:
Щелочная среда: NH3 + HOH ⇄ NH3∙H2O ⇄ NH Кислая среда: HF ⇄ H+ + F– Нейтральная среда: H2O ⇄ H+ + OH– Возрастание кислотности водородных соединений слева направо по периоду объясняется возрастанием полярности связи Э‒Н, а по группе сверху вниз – увеличением длины связи. – ионные (солеобразные) гидриды, не проводящие электрический ток. К ним относятся соединения водорода с активными металлами (NaH, CaH2). Ионные гидриды выделяют водород при взаимодействии с водой и кислотами; – металлоподобные нестехиометрические гидриды, проводящие электрический ток. Их образуют d - и f -элементы. Большинство металлоподобных гидридов имеют переменный состав и высокую подвижность водорода. Биогенная роль водорода Водород вместе с азотом, кислородом и углеродом входит в группу так называемых элементов-органогенов. Именно из этих элементов в основном и состоит организм человека. Доля водорода в нем по массе достигает 10%, а по числу атомов ‒ 50% (каждый второй атом в организме – водород). Водород входит в состав воды, белков, жиров, углеводов, витаминов, биологически активных веществ и т. д. Наибольшую ценность представляет соединение водорода с кислородом – вода, которая составляет основную массу любого живого организма. Содержание воды в теле только что родившегося человека составляет 77%, в зрелом возрасте оно уменьшается до 50% у женщин и 60–62% у мужчин. В организме непрерывно происходит обмен воды и растворенных в ней веществ. Поэтому рекомендуется каждому человеку употреблять не менее 1,5 л воды в день. Другой группой важных соединений водорода являются кислоты. Их способность высвобождать ион водорода делает возможным формирование рН среды. Немаловажной функцией водорода также является его способность образовывать водородные связи, которые, например, формируют в пространстве активные формы белков и структуру ДНК. Применение водорода Применение водорода основано на его физических и химических свойствах: – как легкий газ, он используется для наполнения аэростатов (в смеси с гелием); – кислородно-водородное пламя применяется для получения высоких температур при сварке металлов (температура до 4000°С);
– как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов; – промышленный синтез NH3, HCl, CH3OH; – гидрирование органических соединений (в частности, гидрогенизация растительных масел в твердые жиры); – переработка тяжелых остатков нефти в более ценное моторное топливо; очистка нефти от соединений серы; – в качестве экологически чистого топлива, ракетного топлива, в термоядерных реакциях.
Тема 9. ОБЩАЯ ХАРАКТЕРИСТИКА d -ЭЛЕМЕНТОВ d -элементы называют главными переходными элементами. Они характеризуются застройкой внутрених d -орбиталей, s -орбиталь их внешней оболочки заполняется до заполнения d -орбиталей. Валентными у d -элементов являются внешние s - и предвнешние d -Элементы образуют три переходных ряда – в 4-м, 5-м и 6-м периодах соответственно. Первый переходный ряд включает 10 элементов от скандия до цинка. Он характеризуется внутренней застройкой 3 d -орбиталей:
Хром и медь имеют на 4 s -орбиталях всего по одному электрону. Полузаполненные или заполненные d -подуровни обладают большей устойчивостью. В атоме хрома на каждой из пяти 3 d -орбиталей имеется по одному электрону (полузаполненная подоболочка). В атоме меди на каждой из пяти 3 d -орбиталей находится по паре электронов (заполненная подоболочка). d -элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к образованию комплексных ионов; образование окрашенных соединений. Цинк часто не относят к числу переходных элементов. Его физические и химические свойства не позволяют относить его к переходным металлам. В частности, в своих соединениях он проявляет только одну степень окисления +2, электроны d -подоболочки не участвуют в образовании связей, он не проявляет каталитической активности. Физические свойства. Все d -элементы являются металлами. Большинство из них имеют характерный металлический блеск. По сравнению с s -металлами их прочность в целом значительно выше. Для них характерны ковкость (их можно расплющить ударами в листы), тягучесть, высокий предел прочности на разрыв. d -элементы в целом характеризуются высокими температурами плавления и кипения. Их твердость и высокие температуры плавления и кипения объясняются прочными связями. Наличие прочной металлической связи обусловлено способностью d -элементов поставлять на образование связи электроны не только из внешней, но и из предвнешней электронной d -подоболочки. d -Элементы характеризуются высокой плотностью. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы
d -Элементы – хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s -электрон сверх полузаполненной или заполненной d -оболочки. Металлы с заполненной s -оболочкой обладают меньшей электропроводностью. Медь, серебро, золото, обладающие внешней электронной конфигурацией d 10 s 1, проводят электрический ток лучше, чем цинк, кадмий и ртуть, обладающие электронной конфигурацией d 10 s 2. Хром, молибден и вольфрам, имеющие электронную конфигурацию d 5 s 1, характеризуются более высокой электропроводностью по сравнению с марганцем, технецием и рением, имеющими конфигурацию d 5 s 2. d -Элементы обладают некоторыми особенностями по сравнению с элементами главных подгрупп. 1. У d -элементов лишь небольшая часть валентных электронов делокализована по всему кристаллу (тогда как у щелочных и щелочноземельных металлов валентные электроны полностью отданы в коллективное пользование). Часть d -электронов участвуют в образовании направленных ковалентных связей между соседними атомами. Таким образом, эти элементы в кристаллическом состоянии обладают не чисто металлической связью, а ковалентно-металлической. Поэтому все они твердые (кроме Hg) и тугоплавкие (за исключением Zn, Cd) металлы. Наиболее тугоплавки металлы V В и VI В групп. У них максимально возможное число неспаренных электронов, а следовательно, наибольшее число ковалентных связей. Дальнейшее заполнение приводит к уменьшению числа ковалентных связей и падению температур плавления. 2. Вследствие незаполненности d -подуровня и наличия близких по энергии незаполненных ns - и np -подуровней катионы d -элементов склонны к комплексообразованию; их комплексные соединения, как правило, окрашены и парамагнитны. 3. Для d -элементов характерен большой набор валентных состояний и, как следствие этого, изменение кислотно-основных и окислительно-восстановительных свойств в широких пределах. Поскольку часть валентных электронов находится на s -орбиталях, то проявляемые ими низшие степени окисления, как правило, равны +2. Исключение составляют элементы, ионы которых Э3+ и Э+ имеют устойчивые конфигурации d 0, d 5 и d 10: Sc3+, Fe3+, Cu+, Ag+, Au+. Соединения, в которых d -элементы находятся в низшей степени окисления, образуют кристаллы ионного типа, в химических реакциях проявляют основные свойства и являются, как правило, восстановителями. Устойчивость соединений, в которых d -элементы находятся в высшей степени окисления (равной номеру группы), увеличивается в пределах каждого переходного ряда слева направо, достигая максимума для 3 d -элементов у Mn, а во втором и третьем переходных рядах – у Ru и Os соответственно. В пределах одной подгруппы стабильность соединений высшей степени окисления уменьшается в ряду 5 d > 4 d > 3 d, о чем свидетельствует характер изменения значений стандартных энергий Гиббса образования однотипных соединений, например:
Это явление связано с тем, что при увеличении главного квантового числа в пределах одной подгруппы происходит уменьшение разности энергий (n – 1) d - и ns -подуровней. Соединения, в которых Соединения, в которых d -элементы находятся в промежуточных степенях окисления, проявляют амфотерные свойства и окислительно-восстановительную двойственность. Поскольку для d -элементов в пределах подгруппы устойчивость высших степеней окисления сверху вниз растет, то окислительные свойства соединений высшей степени окисления резко падают. Так, соединения хрома (VI) (CrO3, K2CrO4, K2Cr2O7) и марганца (VII) (Mn2O7, KMnO4) – сильные окислители, а WO3, Re2O7 и соли соответствующих им кислот (H2WO4, HReO4) восстанавливаются с трудом. 4. Сходство d -элементов с элементами главных подгрупп в полной мере проявляется у элементов третьей группы ns 2 np 1 и (n – 1) d 1 ns 2. С возрастанием номера группы оно уменьшается; элементы VIII А подгруппы – газы, VIII В – металлы. В первой группе снова появляется отдаленное сходство (все элементы – металлы), а элементы I В подгруппы – хорошие проводники; это сходство усиливается во второй группе, так как d -электроны Zn, Cd и Hg не участвуют в образовании химической связи. 5. d -элементы III В – VII В подгрупп в высших степенях окисления по свойствам подобны соответствующим p -элементам. Так, в высших степенях окисления Mn (VII) и Cl (VII) являются электронными аналогами. Подобие электронных конфигураций (s 2 p 6) приводит к подобию свойств соединений семивалентных марганца и хлора. Mn2O7 и Cl2O7 в обычных условиях малоустойчивые жидкости, являющиеся ангидридами сильных кислот с общей формулой НЭО4. В низших степенях окисления марганец и хлор имеют различное электронное строение, что обусловливает резкое отличие свойств их соединений. Например, низший оксид хлора Cl2O (s 2 p 4) – газообразное вещество, являющееся ангидридом хлорноватистой кислоты (HClO), тогда как низший оксид марганца MnO (d 5) представляет собой твердое кристаллическое вещество основного характера. 6. Восстановительная способность металла определяется не только его энергией ионизации (М – ne – → М n +; ∆ H оиониз > 0), но и энтальпией гидратации образовавшегося катиона (М n + + m H2O = М n + · m H2O; ∆ H В периоде с ростом порядкового номера восстановительные свойства металлов уменьшаются, достигая минимума у элементов I В группы. Тяжелые металлы VIII В и I В групп за свою инертность названы благородными. 7. На кислотно-основные свойства гидроксидов d -элементов влияют те же факторы (величина ионного радиуса и заряд иона), что и на гидроксиды p -элементов. Гидроксиды низших степеней окисления d -элементов обычно проявляют основные свойства, а отвечающие высшим степеням окисления – кислотные. В промежуточных степенях окисления гидроксиды амфотерны. Особенно отчетливо изменение кислотно-основных свойств гидроксидов при изменении степени окисления проявляется в соединенинях марганца. В ряду Mn(OH)2 – Mn(OH)3 – Mn(OH)4 – H2MnO4 – HMnO4 свойства гидроксидов меняются от слабого основания Mn(OH)2 через амфотерные Mn(OH)3 и Mn(OH)4 к сильной кислоте HMnO4. В пределах одной подгруппы гидроксиды d -элементов одинаковой степени окисления характеризуются увеличением основных свойств при движении сверху вниз. Например, в III В группе Sc(OH)3 – слабое, а La(OH)3 – сильное основание. Элементы IV В группы Ti, Zr, Hf образуют амфотерные гидроксиды Э(OH)4, но кислотные свойства их ослабевают при переходе от Ti к Hf. 8. Отличительной особенностью переходных элементов является образование фаз переменного состава. Это, во-первых, твердые растворы внедрения и замещения и, во-вторых, соединения переменного состава. Твердые растворы образуются элементами с близкими электроотрицательностями, атомными радиусами и одинаковыми кристаллическими решетками. Чем больше отличаются элементы по своей природе, тем менее они растворяются друг в друге и тем более склонны к образованию химических соединений. Такие соединения могут иметь как постоянный, так и переменный состав. В отличие от твердых растворов, в которых сохраняется решетка одного из компонентов, для соединений характерно образование новой решетки и новых химических связей. Другими словами, к химическим соединениям относят лишь те фазы переменного состава, которые резко отличаются по строению и свойствам от исходных. Для соединений переменного состава характерны следующие особенности: а) состав этих соединений зависит от способа получения. Так, в зависимости от условий синтеза оксиды титана имеют состав TiO1,2–1,5 и TiO1,9–2,0; карбиды титана и ванадия – TiC0,6–1,0 и VС0,58–1,09, нитрид титана TiN0,45–1,00; б) соединения сохраняют свою кристаллическую решетку при значительных колебаниях количественного состава, то есть имеют широкую область гомогенности. Так, TiC0,6–1,0, как следует из формулы, сохраняет решетку карбида титана при недостатке в ней до 40% атомов углерода; в) природа связи в таких соединениях определяется степенью заполнения d -орбиталей металла. Электроны внедренного неметалла заселяют вакантные d -орбитали, что приводит к усилению ковалентности связей. Именно поэтому доля металлической связи в соединениях начальных элементов d -рядов (IV–V групп) понижена. Наличие ковалентной связи в них подтверждается большими положительными энтальпиями образования соединений, более высокими твердостью и температурой плавления, меньшей электропроводностью по сравнению с образующими их металлами. Стандартные окислительно-восстановительные потенциалы всех металлов первого переходного ряда, за исключением меди (и серебра во втором переходном ряду), в системах М2+/М отрицательны. Металлы первого переходного ряда, за исключением меди, расположены в электрохимическом ряду напряжений до водорода. Поэтому они должны вытеснять водород из минеральных кислот. Однако некоторые из них реагируют с кислотами медленно, потому что на поверхности металла образуется защитный слой оксида. Это объясняет пассивность таких металлов, как хром, в коррозионных средах. Нахождение металлов в природе. Самыми распространенными в земной коре металлами являются:
Редкие металлы – это металлы, массовая доля которых в земной коре ≤ 0,01% (например: Ti, Pt, Pd). Рассеянные металлы – это металлы, которые не образуют собственных руд (например: Sc, Tl, Hf). Форма нахождения металлов в природе определяется их химической активностью. Малоактивные металлы встречаются в природе, как в соединениях, так и в свободном виде (самородные металлы): Au, Cu, Ag, Pt, Hg. Химически активные металлы находятся в природе только в виде соединений. Получение металлов из их соединений – это задача металлургии. Металлургия – это наука о промышленных способах получения металлов из руд. Любой металлургический процесс является процессом восстановления ионов металла с помощью различных восстановителей, в результате которого получаются металлы в свободном виде. Металлургическими методами получают большинство металлов и множество сплавов. В зависимости от способа проведения металлургического процесса различают пирометаллургию, гидрометаллургию и электрометаллургию.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 31; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.62.45 (0.076 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
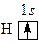
 2HCl;
2HCl; 2Н2О;
2Н2О;

 2H2↑ + O2↑;
2NaCl + 2H2O
2H2↑ + O2↑;
2NaCl + 2H2O  Fe3O4 + 4H2
5. Крекинг (пиролиз) метана, в результате которого также получается сажа (очень чистый углерод):
CH4
Fe3O4 + 4H2
5. Крекинг (пиролиз) метана, в результате которого также получается сажа (очень чистый углерод):
CH4 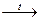 C + 2H2↑
C + 2H2↑

 Кислотность
Кислотность NH3
NH3
 H2O
H2O
 + OH–
+ OH–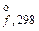 ,кДж/моль
,кДж/моль
 < 0). Энергии ионизации d -элементов в сравнении с другими металлами велики, но они компенсируются большими энтальпиями гидратации их ионов. Вследствие этого электродные потенциалы большинства d -элементов отрицательны.
< 0). Энергии ионизации d -элементов в сравнении с другими металлами велики, но они компенсируются большими энтальпиями гидратации их ионов. Вследствие этого электродные потенциалы большинства d -элементов отрицательны.



