
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика элементов
К s -элементам II группы относятся: бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba, радий Ra. Полные электронные формулы этих элементов: 4 Be 1 s 2 2 s 2; 12 Mg 1 s 22 s 22 p 6 3 s 2; 20 Ca 1 s 22 s 22 p 63 s 23 p 6 4 s 2; 38 Sr 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 6 5 s 2; 56 Ba 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 6 6 s 2; 88 Ra 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 24 f 145 d 106 p 6 7 s 2. На внешнем электронном уровне атомов 2 электрона. Сокращенная электронная конфигурация … ns 2. Электронно-графические схемы в невозбужденном и возбужденном состояниях:
В соединениях металлы проявляют единственную степень окисления +2. Ca, Sr, Ba, Ra называют щелочноземельными металлами. Основные характеристики s -элементов II группы представлены в табл. 6.1. Значения, указанные в скобках, получены методом полуэмпирического расчета. Таблица 6.1 Основные характеристики s -элементов II группы
С ростом атомного номера элемента наблюдается последовательное возрастание радиусов атомов и уменьшение энергий ионизации. Следовательно, в ряду Be – Ba металлические свойства элементов усиливаются. Металлический характер элементов подтверждается и низкими значениями относительной электроотрицательности атомов. Для s -элементов II группы температуры плавления и кипения изменяются немонотонно. Это объясняется неодинаковым типом кристаллической решетки рассматриваемых металлов. Распространение в природе: Ca – 2,96 масс. %, Mg – 2,4 масс. %. В свободном состоянии Be, Mg и щелочноземельные металлы не существуют. Важнейшие минералы, содержащие s -элементы II группы:
Получение. Бериллий получают восстановлением фторида:
BeF2 + Mg Барий получают восстановлением оксида: 3BaO + 2Al Остальные металлы получают электролизом расплавов хлоридов. В электролизере происходят следующие электродные реакции: катод ⊝: Ca2+ + 2e– = Ca; анод ⊕: 2Cl– – 2e– = Cl2; CaCl2 Физические свойства. Металлы II А группы – это серебристо-белые металлы, быстро тускнеющие на воздухе. Металлы II А группы тверже и тяжелее, чем щелочные металлы. Однако их плотность меньше 5 г/см3, поэтому они относятся к легким металлам. Химические свойства. Металлы главной подгруппы II группы – сильные восстановители. С увеличением радиусов и уменьшением энергии ионизации элементов их восстановительная способность увеличивается по ряду Be – Mg – Ca – Sr – Ba. Металлы II А группы довольно реакционноспособны, хотя в меньшей степени, чем щелочные металлы. Химическая активность наиболее высока у бария (примерно такая же, как у лития). Химические свойства бериллия во многом похожи на свойства алюминия (диагональное сходство в периодической системе). Например, подобно алюминию, бериллий растворяется в щелочах и пассивируется в HNO3(конц.). С кислородом щелочноземельные металлы соединяются при обычных условиях, бериллий и магний – при нагревании: 2Ca + O2 = 2CaO; 2Mg + O2 С водородом щелочноземельные металлы и магний соединяются при нагревании, образуя гидриды: Ca + H2 Бериллий с водородом не взаимодействует. Гидриды – сильные восстановители. Они разлагаются водой и кислотами с выделением водорода: CaH2 + 2H2O = Ca(OH)2 + 2H2↑; CaH2 + 2HCl = CaCl2 + 2H2↑. Легко окисляются при слабом нагревании: CaH2 + O2 С галогенами реагируют при нагревании: Ca + Cl2 При нагревании металлы IIА группы реагируют с серой, азотом, фосфором, углеродом, кремнием: Сa + S 3Са + N2 3Сa + 2P Ca + 2C 2Ca + Si Нитриды, фосфиды, карбиды и силициды разлагаются водой и кислотами, например: Ca2Si–4 + 4HCl = 2CaCl2 + Si+4H С водой щелочноземельные металлы реагируют при комнатной температуре с образованием щелочей:
Ca + 2H2O = Ca(OH)2 + H2↑. Бериллий в водой не реагирует. Магний реагирует с водой при нагревании: Mg + 2H2O С кислотами-неокислителями: Ca + 2HCl = CaCl2 + H2; Mg + H2SO4(разб) = MgSO4 + H2. С концентрированной серной кислотой: 4Са + 5H2SO4(конц) = 4СаSO4 + H2S↑ + 4H2O. С азотной кислотой взаимодействие металлов протекает по-разному, в зависимости от концентрации кислоты: Са + 4HNO3(60%) = Са(NO3)2 + 2NO2↑ + 2H2O; 3Са + 8HNO3(30%) = 3Са(NO3)2 + 2NO↑ + 4H2O; 4Са + 10HNO3(20%) = 4Са(NO3)2 + N2O↑ + 5H2O; 5Са + 12HNO3(10%) = 5Са(NO3)2 + N2↑ + 6H2O; 4Са + 10HNO3(2–3%) = 4Са(NO3)2 + NH4NO3 + 3H2O. Бериллий растворяется в водных растворах щелочей: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2. Кальций используют для получения некоторых неметаллов и металлов из оксидов (кальцийтермия): 3Сa + Cr2O3 2Ca + SiO2 2Ca + CO2 При нагревании в парах аммиака образуют нитриды: 3Са + 2NH3(газ) Качественная реакция на катионы металлов IIА группы – окрашивание пламени: кальций – в оранжевый цвет; барий – в зеленый. Катион Ba2+ можно обнаружить обменной реакцией с серной кислотой или ее солями: BaCl2 + H2SO4 = BaSO4↓ + 2HCl; Ba2++ SO Сульфат бария BaSO4 – белый осадок, нерастворимый в минеральных кислотах. Физические свойства оксидов и гидроксидов металлов II группы главной подгруппы. Все соединения щелочноземельных металлов имеют ионный характер. Оксиды – белые тугоплавкие вещества. ВеО в воде не растворим, MgO растворяется только при нагревании. Остальные оксиды достаточно хорошо растворимы в воде с образованием соответствующих щелочей. Гидроксиды – белые порошкообразные вещества, гигроскопичны, в воде растворимы хуже, чем гидроксиды щелочных металлов. Растворимость гидроксидов уменьшается с уменьшением порядкового номера элемента. Химические свойства оксидов и гидроксидов металлов II группы главной подгруппы. С увеличением металлических свойств элементов усиливается основный характер их оксидов и гидроксидов:
Химические свойства оксидов BeO – амфотерный оксид,проявляет как кислотные, так и основные свойства, в воде нерастворим:
Oстальные оксиды – основные. С увеличением основности возрастает растворимость в воде: MgO + H2O CaO + H2O = Ca(OH)2. Все оксиды легко растворимы в кислотах, взаимодействуют с кислотными оксидами: CaO + 2HNO3 = Ca(NO3)2 + H2O; CaO + SO3 = CaSO4.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 53; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.44.23 (0.017 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 Уменьшение
Уменьшение , В
, В Усиление восстановительных свойств
Усиление восстановительных свойств

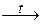 Be + MgF2
Be + MgF2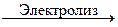 Ca + Cl2.
Ca + Cl2. .
. ;
; ;
; ↑.
↑. = BaSO4↓.
= BaSO4↓. Be(OН)2
Be(OН)2



