
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика элементовСодержание книги
Поиск на нашем сайте
Сокращенная электронная конфигурация … ns 2 np 2. На внешнем электронном уровне атомов 4 электрона. В невозбужденном состоянии атомы имеют по 2 неспаренных электрона. Поскольку атомы всей подгруппы имеют на внешнем уровне свободные р -орбитали, то при переходе в возбужденное состояние электроны s -подуровней распариваются:
Основные характеристики атомов р -элементов IV А группы представлены в табл. 4.1. Таблица 4.1 Основные характеристики р -элементов IV А группы
Примечание *графит под давлением 10,3 ГПа.
В подгруппе с ростом порядкового номера проявляется тенденция к уменьшению энергии ионизации, электроотрицательности атомов, увеличению ковалентного и металлического радиусов. Неметаллические свойства элементов ослабевают, а металлические усиливаются. Углерод и кремний относят к неметаллам; германий, олово и свинец – к металлам. В соединениях элементы подгруппы углерода проявляют степень окисления +4 и –4, а также +2. Для свинца наиболее характерная степень окисления+2. Для углерода, кремния и германия наиболее типична степень окисления +4. Степень окисления –4 в последовательности C – Pb становится все менее характерной.
Углерод. Аллотропия Углерод встречается в свободном состоянии – в форме графита и алмаза, входит в состав атмосферы в виде углекислого газа, содержится в природных карбонатах, каменном и буром угле, нефти и природном газе. Он является составной частью всех органических соединений, входит в состав всех живых организмов на Земле, это элемент жизни. Углерод имеет следующие основные аллотропные модификации: алмаз, графит, карбин, графен, фуллерены.
Графит – мягкое вещество серого цвета со слабым металлическим блеском, жирное на ощупь, проводит электрический ток; ρ = 2,5 г/см3. Атомы углерода находятся в состоянии sp 2-гибридизации и связаны в плоские слои, состоящие из соединенных ребрами шестиугольников, наподобие пчелиных сот. Каждый атом в слое образует три ковалентные связи с соседними атомами углерода. Для образования трех ковалентных связей атом углерода предоставляет три электрона. Четвертая негибридная р -орбиталь атома углерода, располагающаяся перпендикулярно плоскости перекрывания sp 2-гибридных орбиталей, перекрывается своими боковыми областями с тремя подобными орбиталями трех соседних атомов. Таким образом, выше и ниже плоскости находятся единые для всех атомов углерода зоны π-перекрывания. В этом общем электронном облаке электроны уже не относятся к какому-либо определенному атому углерода, а принадлежат всем атомам, находящимся на плоскости. Графит проводит электрический ток по слою атомов, но не между слоями. В графите слои атомов легко скользят относительно друг друга. Когда пишут графитовым карандашом по бумаге, на ней остаются сместившиеся и прилипшие к бумаге слои атомов. В то же время, графит не рассыпается на слои атомов, это свидетельствует о том, что слои взаимодействуют между собой. Связи между плоскостями (слоями) достаточно слабые, их длина почти в 2,5 раза больше, чем межъядерное расстояние С–С в плоскости. Графит – наиболее устойчивая при комнатной температуре аллотропная модификация углерода. К разновидностям графита относят также сажу и древесный уголь. Как показывает рентгеноструктурное исследование, эти вещества состоят из мельчайших беспорядочно расположенных частиц графита. Высокодисперсный углерод обладает значительной адсорбционной способностью. Одним из широко используемых адсорбентов является активированный уголь. Его получают обработкой древесного угля перегретым водяным паром, который удаляет смолистые вещества, заполняющие поры угля. Суммарная поверхность всех пор в 1 г активированного угля может доходить до 1000 м2. Адсорбционная способность активированного угля выше для газов, которые легко сжижаются (SО2, NН3, С12) по сравнению с трудно сжижающимися газами (Н2, О2, СН4). На практике активированный уголь используют в противогазах (поглощает многие отравляющие вещества: хлор, фосген, иприт и др.). В нефтяной промышленности активированным углем улавливают пары бензина из природных нефтяных газов. В пищевой промышленности на сахарных заводах окрашенные сиропы обесцвечивают, обрабатывая их активированным углем (уголь поглощает красящие пигменты); винный спирт, фильтруя через активированный уголь, очищают от ядовитых примесей (сивушных масел). Высокой адсорбционной способностью обладают угли, получаемые при обугливании животных остатков. Костяной уголь содержит 7‒11% углерода и около 80% фосфата кальция. Костяной уголь используют в медицине для поглощения некоторых ядовитых веществ, попавших в организм человека. Карбин – цепочечный полимер, имеющий две формы: …‑С≡С–С≡С‑… и …=С=С=С=С=… Полиин (α-карбин) Поликумулен (β-карбин) Структуру карбина образуют атомы углерода, собранные в цепочки чередующимися одинарными и тройными связями (α-карбин) или двойными связями (β-карбин). Полимерные цепочки имеют химически активные концы (т. е. несут локализованный отрицательный заряд) и изгибы в местах соединения цепочек между собой за счет перекрывания р -орбиталей атомов углерода. Карбин получают каталитическим окислением ацетилена. Карбин обладает полупроводниковыми свойствами, под воздействием света его проводимость сильно увеличивается. На этом свойстве основано его практическое применение в фотоэлементах.
Способ получения графена основан на механическом отщеплении или отшелушивании слоев графита от высокоориентированного пиролитического графита. Сначала плоские куски графита помещают между липкими лентами (скотч) и расщепляют раз за разом, создавая достаточно тонкие слои (среди многих пленок могут попадаться однослойные и двуслойные, которые и представляют интерес). Этот метод не предполагает использования масштабного производства, поскольку это ручная процедура. Он позволяет получать наиболее качественные образцы с высокой подвижностью носителей. Другой известный способ – метод термического разложения подложки карбида кремния – гораздо ближе к промышленному производству. Графен пока недостаточно изучен. Полагают, что в скором времени появится новый класс графеновой наноэлектроники с базовой толщиной транзисторов до 10 нм. Еще одна перспективная область применения графена – его использование для изготовления электродов для использования их в качестве перезаряжаемых источников тока с удельной энергоемкостью, сравнимую с таковой для свинцово-кислотных аккумуляторов. За «передовые опыты с двумерным материалом – графеном» А. К. Гейму и К. С. Новоселову была присуждена Нобелевская премия по физике за 2010 год. Идеальный графен состоит исключительно из шестиугольных ячеек. Присутствие пяти- и семиугольных ячеек будет приводить к различного рода дефектам.
При сворачивании графена в цилиндр получается одностенная нанотрубка. В зависимости от конкретной схемы сворачивания графитовой плоскости нанотрубки могут обладать или металлическими, или полупроводниковыми свойствами. Открыта сверхпроводимость углеродных нанотрубок. Области их применения разнообразны: ‒ в микроэлектронике: транзисторы, нанопровода, прозрачные проводящие поверхности, топливные элементы; ‒ в новейших нейрокомпьютерных разработках для создания соединений между биологическими нейронами и электронными устройствами; ‒ капиллярные применения: капсулы для активных молекул, хранение металлов и газов, нанопипетки и др.; ‒ применение механических свойств: сверхпрочные нити, композитные материалы, нановесы. Результаты экспериментов, проведенных в последние годы, показали, что длинные многостенные углеродные нанотрубки могут вызвать отклик, аналогичный асбестовым волокнам. У людей, занятых на добыче и переработке асбеста, вероятность возникновения опухолей и рака легких в несколько раз больше, чем у основного населения. К аморфным модификациям углерода относится еще одна форма углерода - стеклоуглерод, которую получили искусственным путем. Он состоит из связанных между собой фрагментов алмаза, графита и карбина. Стеклоуглерод – очень легкий, механически прочный, твердый, электропроводящий, коррозионно-устойчивый (устойчив к действию царской водки) и термостойкий материал. Он выдерживает нагревание до 3700°С. Графит и стеклоуглерод широко используются в качестве материала для электродов в процессах электролиза. Из стеклоуглерода изготавливают химическую посуду – тигли, стаканы, трубки и пр., а также рыболовные удочки, рамы спортивных велосипедов, корпуса лодок, летательных аппаратов, самолетов и ракет.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 94; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.107.223 (0.008 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

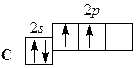
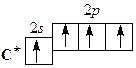
 Увеличение
Увеличение
 Уменьшение
Уменьшение , В
, В
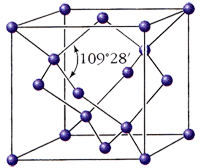 Алмаз – кристаллическое вещество, прозрачное, сильно преломляет лучи света, самое твердое из природных веществ, не проводит электрический ток, плохо проводит тепло,
Алмаз – кристаллическое вещество, прозрачное, сильно преломляет лучи света, самое твердое из природных веществ, не проводит электрический ток, плохо проводит тепло,  Графе́н – двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, находящихся в sp ²-гибридизации и соединенных посредством σ- и π-связей в гексагональную двумерную кристаллическую решетку. Графен впервые был получен в 2004 году. Его можно представить как одну плоскость графита, отделенную от объемного кристалла. Графен обладает большой механической жесткостью и хорошей теплопроводностью. Высокая подвижность носителей заряда (максимальная подвижность электронов среди всех известных материалов) делает его перспективным материалом для использования в самых различных приложениях, в частности, как будущую основу наноэлектроники и возможную замену кремния в интегральных микросхемах.
Графе́н – двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, находящихся в sp ²-гибридизации и соединенных посредством σ- и π-связей в гексагональную двумерную кристаллическую решетку. Графен впервые был получен в 2004 году. Его можно представить как одну плоскость графита, отделенную от объемного кристалла. Графен обладает большой механической жесткостью и хорошей теплопроводностью. Высокая подвижность носителей заряда (максимальная подвижность электронов среди всех известных материалов) делает его перспективным материалом для использования в самых различных приложениях, в частности, как будущую основу наноэлектроники и возможную замену кремния в интегральных микросхемах.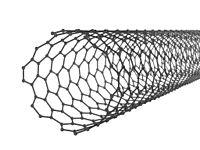
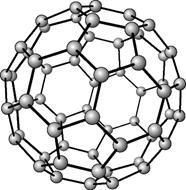 Наличие пятиугольных ячеек приводит к сворачиванию атомной плоскости в конус. Структура с 12 такими дефектами одновременно известна под названием фуллерен. Фуллерены С60, С70 и др. – шарообразные полые молекулы, образованные пяти- и шестиугольниками из атомов углерода, соединенных между собой. Названы по имени американского архитектора Бакминстера Фуллера, применявшего для постройки куполов своих зданий пяти- и шестиугольники. Фуллерены представляют собой кристаллические вещества черного цвета с металлическим блеском, обладают магнитными и сверхпроводящими свойствами, при высоком давлении С60 становится твердым, как алмаз.
Наличие пятиугольных ячеек приводит к сворачиванию атомной плоскости в конус. Структура с 12 такими дефектами одновременно известна под названием фуллерен. Фуллерены С60, С70 и др. – шарообразные полые молекулы, образованные пяти- и шестиугольниками из атомов углерода, соединенных между собой. Названы по имени американского архитектора Бакминстера Фуллера, применявшего для постройки куполов своих зданий пяти- и шестиугольники. Фуллерены представляют собой кристаллические вещества черного цвета с металлическим блеском, обладают магнитными и сверхпроводящими свойствами, при высоком давлении С60 становится твердым, как алмаз.


