
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика элементов
VI A группа: O (кислород), S (сера), Se (селен), Te (теллур) и Po (полоний – радиоактивный элемент). Общее название – халькогены. Полные электронные формулы атомов халькогенов: 8O: 1 s 2 2 s 2 2 р 4; 16S: 1 s 22 s 22 р 6 3 s 23 р 4; 34Se: 1 s 22 s 22 р 63 s 23 р 6 4 s 24 р 4; 52Te: 1 s 22 s 22 р 63 s 23 р 63 d 104 s 24 р 64 d 10 5 s 25 р 4. Сокращенная электронная конфигурация … ns 2 np 4. На внешнем электронном уровне атомов 6 электронов: две электронные пары и два неспаренных электрона:
До завершения внешней электронной оболочки атомам не хватает по два электрона, поэтому все элементы проявляют в своих соединениях минимальную степень окисления ‒2. Кислород по электроотрицательности уступает только фтору. В соединениях с фтором он проявляет положительные степени окисления: O Для кислорода, элемента 2-го периода, максимальная валентность теоретически равна четырем. Однако в соединениях чаще проявляется валентность II, в некоторых соединениях ‒ III:
Кислород – самый распространенный элемент на Земле. В виде простого вещества (О2) кислород входит в состав атмосферы (≈ 21% по объему). В связанном виде кислород – составная часть воды, многих минералов и образуемых ими руд. Сера в природе встречается в самородном состоянии, в виде соединений с металлами – сульфидов: FeS2, PbS, HgS, ZnS. Основные характеристики атомов халькогенов представлены в табл. 2.1. Таблица 2.1 Основные характеристики р -элементов VI A группы
По мере роста заряда ядра атомов увеличивается ковалентный радиус атомов и соответственно уменьшается энергия ионизации. Следовательно, сверху вниз по группе неметаллические свойства элементов халькогенов ослабевают, а металлические нарастают. Для халькогенов значения ковалентных радиусов больше, а энергии ионизации – меньше, чем для галогенов, расположенных в том же периоде. Сродство к электрону у атомов халькогенов достаточно высокое, что указывает на выраженные неметаллические свойства. Однако сродство к электрону меньше, чем для галогенов того же периода. Для кислорода сродство к электрону меньше, чем для серы, что объясняется меньшими размерами атома кислорода и большим межэлектронным расталкиванием в атоме кислорода. С ростом заряда ядра атомов уменьшается электроотрицательность, неметаллические свойства элементов халькогенов по группе ослабевают. Так как у халькогенов электроотрицательность ниже, чем у галогенов, ионный характер связей в бинарных соединениях выражен слабее. Ионный тип связи характерен для соединений со щелочными и щелочноземельными металлами: Na2S, CaO, BaS.
Кислород
Кислород существует в виде двух аллотропных модификаций: кислород и озон. Аллотропия кислорода обусловлена различным числом атомов в молекулах веществ O2 и O3. Кислород и озон обладают различными физическими свойствами:
Получение кислорода в промышленности: 1) фракционная перегонка жидкого воздуха (t кип(O2) = ‒182,95oC), t кип(N2) = ‒195,79oC);
2) электролизом водных растворов щелочей, который сводится к электролизу H2O. Щелочь необходима для электоропроводности раствора: катод ⊝: 2H2O + 2 e – = H2 + 2OH–; анод ⊕: 4OН– – 4 e – = O2 + 2H2O; 2H2O В лаборатории ‒ прокаливание легко разлагающихся кислородсодержащих веществ, таких как H2O2, KClO3, HgO, KNO3, KMnO4:
3O2 2O3 В соответствии с методом ВС порядок связи в молекуле O2 равен 2, неспаренные электроны отсутствуют:
Однако жидкий кислород обладает парамагнитными свойствами, втягивается в магнитное поле, следовательно, у него есть неспаренные электроны. Более правильно объясняет строение молекулы О2 метод молекулярных орбиталей (рис. 2.1):
Два неспаренных электрона на π- разрыхляющих орбиталях обуславливают парамагнетизм молекулы кислорода. Порядок (кратность) связи в молекуле кислорода и соответствующих молекулярных ионах кислорода (равен разнице электронов на связывающих и разрыхляющих орбиталях, деленной на 2): О Порядок связи 2,5 2 1,5 1 Положительный молекулярный диоксигенил-катион О При заполнении одной πразр 2 p -орбитали образуется ион О О2 + e – = О K + O2 = K+O При полном заполнении обеих πразр 2 p -орбиталей происходит образование ионов О 2Na + O2 = Na Химические свойства кислорода. Так как в молекуле кислорода довольно прочная двойная связь О=О, при обычных условиях кислород относительно неактивен. Активность его резко возрастает при повышении температуры. При нагревании кислород реагирует с большинством простых веществ. Исключение – инертные газы, галогены, благородные металлы (Ag, Au, Pt). Реакции с кислородом обычно сопровождаются выделением большого количества тепла и света. Кислород во всех реакциях выполняет функцию окислителя. Горение – быстро протекающая химическая реакция, при которой происходит окисление веществ с выделением тепла и света. Вещества могут гореть не только в атмосфере кислорода, но и в хлоре, фторе и др. В природе протекают также процессы медленного окисления веществ кислородом. К таким процессам относятся коррозия металлов, гниение, дыхание. Наиболее характерные реакции для кислорода:
Озон – сильнейший окислитель, окислительная способность обусловлена нестойкостью его молекул, образованием атомарного кислорода, который активнее молекулы кислорода О2
O3 ⇄ O2 + O, Озон окисляет почти все металлы, неметаллы, обесцвечивает красители, убивает микробы. При высоких концентрациях – яд. Молекула имеет угловое строение (sp 2-гибридизация):
Предполагается, что один из aтомов кислорода находится в возбужденном состоянии, и с ним центральный атом кислора по донорно-акцепторному механизму образует связь. Две sp 2-гибридные орбитали центрального атома кислора образуют σ-связи, а 3-я гибридная орбиталь является несвязывающей и содержит электронную пару. В результате делокализации π-связи образуется трехцентровая двухэлектронная связь с концевыми атомами кислорода. Озон существует в нескольких таутомерных формах. Срединному атому кислорода приписывается степень окисления, равная +4, концевым атомам – –2:
Качественная реакция на озон: крахмальная бумага, смоченная раствором KI, синеет в присутствии озона в результате выделения I2: 2KI + O3 + H2O = I2 + O2 + 2KOH. Озон применяют при обработке питьевой воды, так как он не только уничтожает микроорганизмы, но и устраняет неприятный вкус и запах у воды, содержащей пахучие вещества (сероводород, сернистые соединения и т. д.). Озон также используют для обеззараживания сточных вод, содержащих цианиды и фенолы, для уничтожения запаха у жиров и масел, как дезодоратор в системах кондиционирования воздуха. В воздухе, которым мы дышим, объемная доля О3 составляет
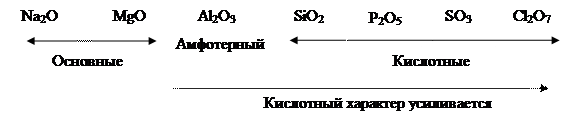
Земля окружена слоем озона, располагающегося на высоте 25 км от ее поверхности. Он образуется за счет поглощения кислородом ультрафиолетового излучения Солнца. Озоновый слой ограничивает поток ультрафиолетового излучения, падающего на Землю. Увеличение интенсивности ультрафиолетового излучения, достигающего Землю, могло бы привести к возрастанию заболеваний раком кожи. Химичесие свойства О3. Озон – сильнейший окислитель, окисляет многие малоактивные металлы (серебро, ртуть), сложные вещества уже при обычных условиях: 2Ag + O3 = Ag2O + O2; PbS + 2O3 = PbSO4 + O2; 2KOH + 7/3O3 = O2 + 2KO3 + H2O. озонид калия Кислород может проявлять положительные степени окисления в соединениях с фтором: +2 (O+2F2) и +1 (О 2F2 + 2NaOH → 2NaF + O В большинстве бинарных соединений кислорода с другими элементами (оксидах) степень окисления кислорода равна –2. Чем более выражены неметаллические свойства элемента, тем более кислотный характер проявляет его оксид:
Если элемент проявляет разные степени окисления и образует несколько оксидов, то чем выше степень окисления элемента, тем более кислотный характер будет проявлять этот оксид:
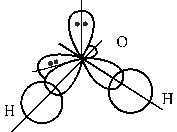
Вода (H2O)– самое распространенное вещество на Земле. Строение молекулы воды установлено экспериментально с большой точностью. Молекула воды имеет угловое строение в виде равнобедренного треугольника с атомом кислорода в вершине. Угол НОН = 104,5°. В соответсвии с методом ВС орбитали атома кислорода находятся в sp 3-гибридном состоянии (рис. 2.2):
Рис. 2.2. Механизм образования связей и строение воды Электронная конфигурация валентной оболочки атома кислорода 2 s 22 р 4. На внешнем электронном уровне у него находятся две неподеленные электронные пары и два неспаренных электрона. При образовании химических связей гибридизации подвергаются все четыре атомные орбитали кислорода. Валентный угол HОН 104,5° близок к теоретическому значению 109°28´. Меньшее значение валентного угла объясняется расталкиванием между собой неподеленных пар электронов. Физические свойства воды. При обычных условиях вода ‑ жидкость без вкуса и запаха. В тонком слое она бесцветна. При толщине более 2 м вода приобретает голубоватый оттенок. Температура плавления ‒ 0°С, температура кипения ‒ +100°С, что значительно выше, чем у H2S, H2Se, H2Te. Аномально высокие температуры плавления и кипения воды объясняются существованием водородных связей между молекулами. Связи Н–О в молекуле воды сильно поляризованы, электроны связи Н–О смещены к более электроотрицательному атому кислорода. Поэтому атомы О приобретают избыточный отрицательный заряд, атомы Н – избыточные положительные заряды. Наличие избыточных зарядов на атомах водорода и кислорода, а также неподеленных электронных пар у атома кислорода обусловливает образование между молекулами воды водородных связей (рис. 2.3).
У воды проявляется еще одна аномалия – аномалия плотности. Как правило, вещество в твердом агрегатном состоянии имеет большую плотность, чем в жидком. Вода в твердом агрегатном состоянии (лед) имеет меньшую плотность, чем жидкая вода. Это объясняется тем, что при образовании водородных связей (рис. 2.3) в алмазоподобной структуре льда образуются пустоты. Поэтому лед имеет меньшую плотность. Плавление льда сопровождается частичным разрушением водородных связей и заполнением пустот молекулами воды. Плотность жидкой воды при Р = 1,013 · 105 Па имеет максимальное значение 1 г/см3 при +4°С. Выше этой температуры плотность воды опять начинает уменьшаться. Однако это уменьшение незначительно, при химических расчетах плотность жидкой воды принимается равной 1 г/см3. Чистая вода имеет незначительную электропроводность, которую можно объяснить самоионизацией воды:
В чистой воде при стандартной температуре концентрации ионов водорода (гидроксония) и гидроксид-ионов равны: С(Н+) = С(ОН‑) = 10‑7моль/л; рН чистой воды при 25°С = 7. Химические свойства воды
Пероксид водорода H2O2 ‒ бесцветная жидкость, неограниченно смешивается с водой. На свету и под действием катализаторов (MnO2) легко разлагается (при нагревании со взрывом): 2H2O2 = 2H2O + O2↑. В водных растворах пероксид водорода значительно устойчивее и является слабой кислотой: H2O2 ⇄ Н+ + НО H2O ⇄ Н+ + ОН– (Kдис = 1,8 · 10-16). Ионизация по второй ступени в водной среде практически не протекает. Как кислота H2O2 реагирует со щелочами: 2NaOH + Н2О2 = Na2О2 + 2Н2О. Пероксид водорода, содержащий кислород в промежуточной степени окисления –1, может выступать в окислительно-восстановительных реакциях либо в качестве окислителя, либо в качестве восстановителя:
Восстановитель Двойственные свойства Окислитель Примеры ОВР с Н2О2 в качестве окислителя: Н2О2 + 2KI + H2SO4 = I2+ K2SO4 + 2Н2О; Н2О2 + 2KI = 2KOH + I2. С сильными окислителями пероксид водорода – восстановитель, окисляется до свободного кислорода: 2KMnO4 + 5Н2О2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 8Н2О. Эти процессы характеризуются следующими значениями стандартных окислительно-восстановительных потенциалов: а) как окислитель: Н2О2 + 2Н+ + 2ē = 2Н2О; Е Н2О2 + 2ē = 2ОН–; Е ˚ = 0,88 В (в щелочной среде); б) как восстановитель: Н2О2 – 2ē = О2 + 2Н+; Е НО Из значений стандартных электродных потенциалов следует, что окислительные свойства у Н2О2 выражены сильнее, чем восстановительные. Окислительные свойства Н2О2 сильнее выражены в кислой среде. В промышленности Н2О2 получают при электролизе 50%-ного раствора серной кислоты с последующим гидролизом пероксодисерной кислоты: анод ⊕: 2SО Н2S2O8 + 2Н2О = 2H2SO4 + Н2О2↑. Образующийся пероксид водорода извлекают из раствора отгонкой в вакууме. В лаборатории Н2О2 получают действием 20%-ной серной кислоты на влажный пероксид бария: Ва + О2 ВаО2 + H2SO4 = ВаSO4↓ + Н2О2. Пероксид водорода окисляет многие органические вещества (волосы, текстильные волокна и др.). На этом свойстве основано использование его разбавленных растворов в качестве обесцвечивающего и отбеливающего средства. Применение пероксида водорода в медицине как дезинфицирующего средства также основано на его окислительной способности. В медицинской практике пероксид водорода применяется как наружное средство в качестве антисептика. Антисептическое действие обусловливается окислительными свойствами пероксида водорода, который выделяет кислород в присутствии ферментов – каталазы крови. Каталаза быстро разлагает пероксид водорода, при этом бурно выделяется кислород, что создает видимость пены. Пероксид водорода применяется как кровоостанавливающее средство при порезах. В продажу пероксид водорода поступает в виде 30%-ного раствора (пергидроля) или 3%-ного водного раствора. Свойства пероксида водорода определяют и условия его хранения – в склянках из оранжевого стекла, имеющего отрицательную реакцию на щелочность. Склянки должны быть закупорены парафинированными или стеклянными пробками. Хранить препарат следует в прохладном, защищенном от света месте, концентрированные растворы более нестойки. Поэтому пергидроль хранят в склянках, покрытых внутри парафином (шероховатая поверхность может ускорить и усилить разложение пероксида водорода). Производные Н2О2 – пероксосоединения. В их структуре существует пероксидная цепочка (−О–О−). Пероксокислоты образуются при замещении атома водорода в молекуле Н2О2 на кислотные радикалы, например:
Сера Сера – типичный неметалл, неметаллические свойства серы выражены слабее, чем у кислорода. При стандартных условиях простое вещество сера представляет собой порошок или кристаллы желтого цвета. Одно из характерных свойств атомов халькогенов – их способность связываться друг с другом в кольца или цепи. Это явление называют катенацией. Причина образования гомоцепей связана с различной прочностью одинарных и двойных связей:
Из приведенных значений следует, что образование двух одинарныхσ-связей для серы вместо одной двойной связано с выигрышем в энергии (530 – 421 = 108,7 кДж). Для кислорода, напротив, одна двойная связь энергетически предпочтительнее (494 – 292 = 201,6 кДж), чем две одинарные. Уменьшение прочности двойной связи при переходе от кислорода к сере связано с увеличением размеров р -орбиталей и уменьшением их перекрывания. Таким образом, для кислорода катенация ограничивается небольшим числом нестойких соединений (например, озон O3). Гомоцепи серы имеют зигзагообразную форму, поскольку в их образовании принимают участие электроны взаимно перпендикулярных р -орбиталей. Аллотропные модификации серы. Существуют три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Ромбическая и моноклинная модификации построены из циклических молекул S8. При комнатной температуре устойчива ромбическая сера. Молекула S8 имеет форму короны (рис. 2.6).
При плавлении кристаллов серы (t пл = 119ºС) разрываются слабые межмолекулярные связи и освобождаются циклические молекулы S8, приобретающие при этом легкую подвижность. Вязкость расплава в этих условиях меньше вязкости воды. При 159,4ºС все свойства жидкой серы изменяются скачкообразно (теплоемкость, плотность, цвет, электропроводность, поверхностное натяжение и др.). Особенно резко меняется вязкость расплава, которая при нагревании до 195ºС возрастает в 10 тысяч раз (расплав перестает выливаться из пробирки). Это связано с процессом полимеризации, в результате которой образуются гомоцепи: цикл S8 → цепь S8; цепь S8 + циклS8 → цепь S16 и т. д. В результате полимеризации образуются цепи длиной более 200 тысяч атомов серы. При дальнейшем нагревании вязкость расплава понижается из-за начинающейся деполимеризации. Цепи постепенно укорачиваются до ~1000 атомов при 400ºС и до ~100 атомов при 600ºС. Выше 445ºС давление насыщенного пара над жидкой серой превышает 105 Па (1атм). В газообразном состоянии присутствуют все молекулы S n (2 ≤ n ≥ 10), включая молекулы с нечетным числом атомов. В промышленности серу получают из самородной серы путем отделения ее от пустой породы. Это достигается выплавлением серы с помощью горячей воды (при повышенном давлении, так как сера плавится при 119° С) в автоклавах. Иногда добычу серы осуществляют путем подачи под давлением нагретой воды в содержащие серу пласты, при этом непосредственно из скважины извлекают смесь расплавленной серы и воды. Кроме того, серу получают из газов, содержащих Н2S и SO2 (природный газ, газы, образующиеся при обжиге сульфидных руд): 2H2S + O2 = 2S + 2H2O; 2H2S + SO2 = 2H2O + 3S. Химические свойства серы
Сероводород H 2 S – ковалентное соединение. В отличие от молекул воды молекулы сероводорода не образуют между собой водородных связей. Атом серы менее электроотрицательный, чем атом кислорода, имеет больший размер и, как следствие, меньшую плотность заряда. Валентный угол HSH составляет 92°, что свидетельствует об отсутствии гибридизации орбиталей атомов серы. Физические свойства. При обычных условиях сероводород – бесцветный газ, с сильным характерным запахом тухлых яиц. H2S придает водному раствору слабокислый характер. При растворении в воде образует слабую двухосновную сероводородную кислоту. Диссоциация сероводородной кислоты протекает обратимо и ступенчато:
Сероводородной кислоте присущи все свойства слабых кислот. Как двухосновная, кислота образует два типа солей – сульфиды (K2S)и гидросульфиды (КHS): H2S + 2KOH = K2S + 2H2O; H2S + KOH = KHS + H2O; H2S + CuSO4 = CuS↓ + H2SO4; H2S + 2NH3 = (NH4)2S. Гидросульфиды, сульфиды щелочных и щелочноземельных металлов хорошо растворимы в воде, сульфиды тяжелых металлов практически нерастворимы. Получение H2S и сульфидов
Аналогично оксидам сульфиды классифицируют в соответствии с типом связей в молекулах сульфидов на кислотные, основные, амфотерные. Характер сульфидов элементов III периода:
Различные по кислотно-основному характеру сульфиды по-разному реагируют с Н2О: основные Na2S + H2O = NaHS + NaOH (рН > 7); амфотерный Al2S3 + 6H2O = 2Al(OH)3¯ + 3H2S; кислотные SiS2 + 3H2O = H2SiO3¯ + 2H2S(рН < 7). Различные по характеру сульфиды взаимодействуют между собой: Na2S + CS2 = Na2CS3 – тиокарбонат натрия; As2S3 + 3Na2S = 2Na3AsS3. Сульфиды по растворимости делят на следующие группы: 1. Растворимые в воде – сульфиды щелочных металлов (Na2S, K2S). 2. Нерастворимые в воде, но растворимые в соляной и разбавленной серной кислоте (ZnS, MnS, FeS): FeS + 2HCl ® FeCl2 + H2S. 3. Нерастворимые в воде и кислотах (PbS, CuS, HgS и др.), реагируют с кислотами-окислителями, проявляя восстановительные свойства: CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O. Сероводород H2S и сульфиды могут окисляться до S, SO2, SO H2S + 4Br2 + 4H2O = H2SO4 + 8HBr; 3H2S + H2SO4 = 4S + 4H2O; 2H2S + O2 = 2S + 2H2O; 2H2S + 3O2(изб) = 2SO2 + 2H2O; H2S + I2 = 2HI + S; H2S + 2HNO3(конц) = S↓ + 2NO2↑ + 2H2O; 2ZnS + O2(нед) = 2ZnO + 2S; MnS(т) + 8HNO3(конц) = MnSO4 + 8NO2↑ + 4H2O. Сульфиды щелочных и щелочноземельных металлов не окрашены, сульфиды других металлов имеют характерную окраску, например сульфиды меди (II), никеля и свинца (II) – черные, сульфиды кадмия, индия, олова – желтые, сульфид сурьмы – оранжевый.Осаждение из растворов характерно окрашенных сульфидов металлов с очень малой растворимостью используют как качественные реакции. Для доказательства присутствия следов сероводорода в воздухе (или растворе) применяют пропитанную раствором ацетата свинца бумагу, которая при наличии H2S чернеет из-за образования сульфида свинца: Н2S + Рb(СН3СОО)2 = РbS↓ + 2СН3СООН. Сульфаны (полисульфиды водорода). Для серы характерно образование гомоцепей. Связи –S−S– сохраняются в полисульфидах водорода (сульфанах). Они имеют зигзагообразные цепи:
Общая формула сульфанов H 2 S n (n = 1‒8): H2S2, H2S3, H2S4 и т. д.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 44; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.27.202 (0.174 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
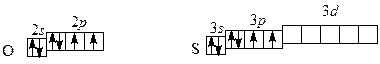
 F2, O+2F2. В пероксидах степень окисления кислорода равна ‑1: H2O
F2, O+2F2. В пероксидах степень окисления кислорода равна ‑1: H2O  , K2O
, K2O  , Н3О+. У серы и атомов халькогенов, расположенных в периодической системе ниже серы, появляются d -подуровни, что повышает валентные возможности элементов. В соответствии с числом неспаренных электронов валентность этих элементов может быть равна четырем и шести:
, Н3О+. У серы и атомов халькогенов, расположенных в периодической системе ниже серы, появляются d -подуровни, что повышает валентные возможности элементов. В соответствии с числом неспаренных электронов валентность этих элементов может быть равна четырем и шести: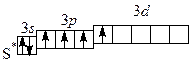

 Увеличение
Увеличение  Увеличение
Увеличение  Уменьшение
Уменьшение
 Уменьшение
Уменьшение Уменьшение
Уменьшение 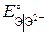 , В
, В Уменьшение
Уменьшение 2H2 + O2.
2H2 + O2. 2BaO + О2;
2BaO + О2;
 Озон получают из кислорода под действием электрического разряда:
Озон получают из кислорода под действием электрического разряда: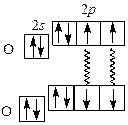
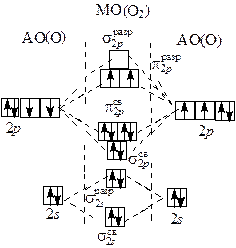
 , О
, О 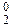 , О
, О  , О
, О 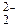
 :
: = –142 кДж.
= –142 кДж.

 F2):
F2):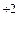 F2 + H2O
F2 + H2O  .
.



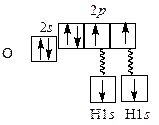

 Mg(OH)2 + H2;
3Fe+ 4H2O
Mg(OH)2 + H2;
3Fe+ 4H2O  Пероксид водорода Н2О2. Строение пероксида водородапоказано на рис. 2.5. Молекула H2O2 неплоская, имеет строение H−O−O−H с σ-связью O−O на ребре и σ-связями H–O на плоскостях двугранного угла. Степень окисления кислорода равна −I, валентность атома O равна 2. Группу
Пероксид водорода Н2О2. Строение пероксида водородапоказано на рис. 2.5. Молекула H2O2 неплоская, имеет строение H−O−O−H с σ-связью O−O на ребре и σ-связями H–O на плоскостях двугранного угла. Степень окисления кислорода равна −I, валентность атома O равна 2. Группу 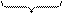
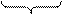


 Н2О-2 Н2О
Н2О-2 Н2О  = 1,776 В (в кислой среде);
= 1,776 В (в кислой среде);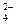 – 2ē = S2О
– 2ē = S2О 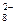 , Е
, Е 

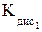 = 6 ∙ 10‒8;
= 6 ∙ 10‒8;
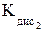 = 1 ∙ 10‒14
= 1 ∙ 10‒14
 Основные
Основные Кислотные
Кислотные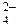 :
:



