
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сравнительная характеристика простых веществ галогеновСодержание книги
Поиск на нашем сайте
В невозбужденном состоянии на внешнем электронном уровне атомов присутствует по одному неспаренному электрону.
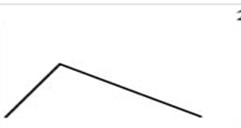
Рис. 1.1. Строение молекулы F2 по методу МО
В молекулах Cl2 , Br2 , I2 в соответствии с методом ВС образуется дополнительная дативная связь, за счет спаренных p -электронов одного атома и вакантных d -орбиталей другого:
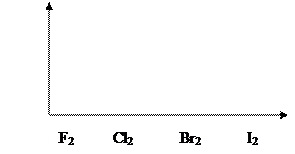
Самой прочной является молекула Cl2. Уменьшение энергии связи от Cl2 к I2 объясняется увеличением длины связи (рис. 1.2):
Рис. 1.2. Изменение энергии связи в молекулах Г2
При обычных условиях F2 – зеленовато-желтый, трудно сжижаемый газ с резким запахом. Фтор крайне токсичен, при попадании в организм человека вызывает отек легких, разрушение зубов, ногтей, ломкость кровеносных сосудов, повышает хрупкость костей. Cl2 – газ желто-зеленого цвета, легко сжижается. Br2 – красно-коричневая густая жидкость со зловонным запахом, ядовит (единственный жидкий при обычных условиях неметалл). I2 – фиолетовые кристаллы. Для человека смертельная доза – 2-3 г иода, но в форме иодид-ионов относительно безвреден. Нахождение в природе. Вследствие высокой химической активности в природе галогены встречаются в виде соединений. F: CaF2 – плавиковый шпат; Na3[AlF6] – криолит; Ca5(PO4)3F – фторапатит. Cl: NaCl – поваренная (каменная) соль; KCl ∙ NaCl – сильвинит; KCl ∙ MgCl2 ∙ 6H2O – карналлит. Br: в нефтяных скважинах, в морской воде, в отложениях хлоридов (в виде бромидов NaBr, KBr, MgBr2). I: в подземных буровых водах, в воде океанов, в морских водорослях, в залежах селитры (иодиды и иодаты). Способы получения галогенов Галогены получают окислением галогенид-ионов, в виде которых они преимущественно находятся в природных соединениях. Фтор характеризуется самым высоким стандартным электродным потенциалом (2,866 В), поэтому окислителем по отношению к иону F– может быть только электрический ток. F 2 в промышленности получают электролизом расплава гидрофторида калия KНF2 или фторида калия в безводной плавиковой кислоте. Фактически электролизу подвергается НF, наличие фторида калия обеспечивает электропроводность расплава. В процессе электролиза температура плавления расплава постепенно повышается из-за увеличения содержания в нем KF. Для восстановления состава электролита его периодически насыщают НF: KНF2 катод анод Å: 2F– – 2 e – = F2. Получение фтора и работа с ним осложняются из-за его высокой реакционной способности. Аппараты и коммуникации для работы с фтором обычно изготавливают из меди или никеля. Эти материалы не разрушаются фтором при температуре электролиза, под действием фтора на их поверхности образуется слой нерастворимых фторидов. Никель – наиболее стойкий по отношению к фтору металл. В лаборатории F 2 получают разложением фторидов: CoF3 → CoF2 + ½F2. Cl 2 в промышленности получают электролизом концентрированных водных растворов хлорида натрия:
Катод Анод Å 2Сl– – 2 е – = Сl2. На угольном аноде выделяется хлор, а на стальном катоде – водород. Поскольку в катодном пространстве остаются ионы натрия, не восстанавливающиеся в условиях процесса, и присутствуют гидроксид-ионы, образующиеся в процессе восстановления воды, то происходит накопление водного раствора щелочи NaOH – третьего товарного продукта. При получении хлора катод может быть изготовлен из ртути. В этом случае в катодном пространстве образуется особенно чистый водный раствор гидроксида натрия, но, поскольку при этом возможны потери ртути, такой способ получения хлора является экологически небезопасным. В лаборатории Cl 2 получают действием концентрированной соляной кислоты на окислители (KMnO4, MnO2, PbO2 и др.), разложением некоторых хлоридов: 16HCl + 2KMnO4 = 5Cl2 + 2MnCl2 + 2KCl + 8H2O; MnO Cl2 + 2е– = 2Сl–; 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O; PbO2 + 4HCl = PbCl2 + Cl2 + 2H2O; 2AuCl3 = 2Au + 3Cl2. Окислительная способность галогенов с увеличением заряда ядра уменьшается, о чем свидетельствует уменьшение значений стандартных электродных потенциалов Бром и иод в промышленности получают из бромидов и иодидов вытеснением хлором, электролизом водных растворов бромидов и иодидов: 2KBr + Cl2 = 2KCl + Br2;
2NaI + 2H2O 2NaOH + H2 + I2. Из иодатов иод получают восстановлением: 5NaHSO3 + 2NaIO3 = 2Na2SO4 + 3NaHSO4 + I2 + H2O. Br2 и I2 могут быть получены в лаборатории при окислении галогенид-ионов неорганическими окилителями: K2Cr2O7 + 6KBr + 7H2SO4 = 2Cr2(SO4)3 + 4K2SO4 + 3Br2 + 7H2O; 8NaI + 5H2SO4(конц) = Na2SO4 + 4I2 + H2S + 4H2O; 4KI + 2СuSO4 = 2СuI + I2 + 2K2SO4.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 128; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.43.200 (0.01 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 увеличение
увеличение
 Увеличение от фтора к хлору и от иода к хлору
Увеличение от фтора к хлору и от иода к хлору Увеличение
Увеличение Увеличение
Увеличение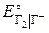 , В
, В Ослабление окислительных свойств
Ослабление окислительных свойств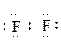
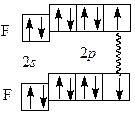 По методу валентных связей (ВС) в молекуле фтора оба атома предоставляют для образования ковалентной связи по одному неспаренному электрону. Электронная пара в равной мере принадлежит обоим атомам. В соответствии с методом молекулярных орбиталей (МО) в молекуле фтора порядок связи также равен 1 (рис. 1.1):
По методу валентных связей (ВС) в молекуле фтора оба атома предоставляют для образования ковалентной связи по одному неспаренному электрону. Электронная пара в равной мере принадлежит обоим атомам. В соответствии с методом молекулярных орбиталей (МО) в молекуле фтора порядок связи также равен 1 (рис. 1.1):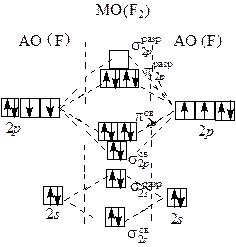
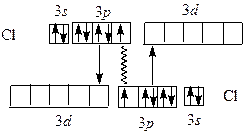







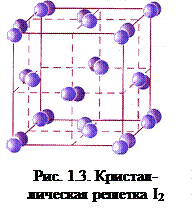 Между молекулами галогенов в конденсированном состоянии осуществляется слабое ван-дер-ваальсово взаимодействие (межмолекулярное взаимодействие между неполярными молекулами называется дисперсионным), поэтому у простых веществ низкие температуры плавления и кипения. Внешние электронные оболочки атомов фтора и хлора находятся на более коротком расстоянии от ядра, чем внешние электронные оболочки атомов брома и иода. Чем ближе к ядру находится внешняя электронная оболочка, тем она более жесткая и менее склонна к деформации. Электронные оболочки брома и иода более рыхлые, в меньшей степени взаимодействуют с ядром. С увеличением размеров атомов возрастает поляризуемость молекул и усиливается способность к межмолекулярному взаимодействию, что приводит к повышению температур плавления и кипения. Для твердого состояния галогенов характерна молекулярная кристаллическая решетка. Например, в узлах кристаллической решетки иода находятся молекулы I2 (рис.1.3).
Между молекулами галогенов в конденсированном состоянии осуществляется слабое ван-дер-ваальсово взаимодействие (межмолекулярное взаимодействие между неполярными молекулами называется дисперсионным), поэтому у простых веществ низкие температуры плавления и кипения. Внешние электронные оболочки атомов фтора и хлора находятся на более коротком расстоянии от ядра, чем внешние электронные оболочки атомов брома и иода. Чем ближе к ядру находится внешняя электронная оболочка, тем она более жесткая и менее склонна к деформации. Электронные оболочки брома и иода более рыхлые, в меньшей степени взаимодействуют с ядром. С увеличением размеров атомов возрастает поляризуемость молекул и усиливается способность к межмолекулярному взаимодействию, что приводит к повышению температур плавления и кипения. Для твердого состояния галогенов характерна молекулярная кристаллическая решетка. Например, в узлах кристаллической решетки иода находятся молекулы I2 (рис.1.3).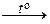 KF + НF;
KF + НF;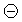 : 2HF + 2 e – = H2 + 2F–;
: 2HF + 2 e – = H2 + 2F–;
 2NaCl + 2H2O 2NaOH + H2 + Cl2;
2NaCl + 2H2O 2NaOH + H2 + Cl2;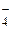 + 8Н+ + 5е– = Mn2+ + 4Н2О,
+ 8Н+ + 5е– = Mn2+ + 4Н2О, 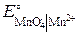 = 1,51 В;
= 1,51 В;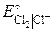 = 1,36 В;
= 1,36 В; 2KI + Cl2 = 2KCl + I2;
2KI + Cl2 = 2KCl + I2;


