
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика элементов⇐ ПредыдущаяСтр 27 из 27
Полная электронная формула атома меди и электронно-графическая схема его валентных электронов: 29 Cu: 1 s 22 s 22 p 63 s 23 p 6 3 d 104 s 1. У меди, серебра и золота наблюдается «проскок» электрона. На внешнем s -подуровне 1 ‒ неспаренный электрон. В табл. 13.1 приведены некоторые свойства этих металлов. Таблица 13.1 Общая характеристика d -элементов I В группы
В основном состоянии атомы элементов I В группы имеют электронную конфигурацию (n – 1) d 10 ns 1, валентные электроны атомов расположены на d - и s -орбиталях. Она напоминает электронную конфигурацию щелочных металлов (n – 1) s 2(n – 1) р 6 ns 1. Однако, несмотря на сходство в строении внешних оболочек атомов I А и I В групп, химические свойства металлов значительно различаются. Это объясняется тем, что заполненные d -орбитали в атомах меди, серебра, золота «экранируют» внешние s -электроны. Поэтому значения первых энергий ионизации имеют для этих элементов высокие значения. Эффект d - и f -сжатия оказывает значительное влияние на величины металлических радиусов элементов. Из приведенных данных видно, что металлические радиусы серебра и золота близки по своим значениям. Из-за роста радиусов первая энергия ионизации в ряду Cu – Ag уменьшается, но при переходе от Ag к Au увеличивается в связи с ростом заряда ядра при одинаковом радиусе. Вторая энергия ионизации оказывается максимальной у серебра, что объясняется устойчивостью состояния …4 d 10, поэтому для серебра характерна степень окисления +1. В водных растворах для меди характерна степень окисления +2, для серебра +1 и для золота +3. Это согласуется с последовательностью изменения энергий ионизации в группе: первая энергия ионизации оказывается минимальной у серебра, в то время как для меди минимальна сумма двух первых, а для золота – трех первых энергий ионизации. Отсюда наиболее устойчивые степени окисления Cu2+, Ag1+, Au3+.
Золото имеет высокую электроотрицательность (2,4), что выше электроотрицательности фосфора (2,19). Большое сродство атома золота к электрону, вызванное высокой стабильностью 6 s 2-электронной конфигурации, объясняет образование ионных соединений, содержащих золото в отрицательной степени окисления, например, CsAu–, K3OAu–. Стабилизация d -подуровня за счет проскока электрона, обусловливает устойчивость степени окисления +1, а также низкую реакционную способность простых веществ. Для них характерны невысокие координационные числа (от 2 до 6). Чистые медь, серебро и золото характеризуются высокой мягкостью, ковкостью, пластичностью, они легко вытягиваются в проволоку. Медь, серебро и золото имеют высокую тепло- и электропроводность, однако наличие примесей значительно снижает их свойства. Так, техническая медь с массовой долей кислорода 0,013%, алюминия ‒ 0,024% и сурьмы ‒ 0,55% проводит электрический ток в три раза хуже, чем чистая медь. Свинец и висмут резко уменьшают пластичность металлов. Различная окраска металлов – розово-красная меди, серебристо-белая серебра и золотисто-желтая золота – обусловлена разной энергией перехода электронов из заполненной d -зоны в зону проводимости, т. е. переходами (п – 1)d10ns1 → (п – 1)d9ns2. Для меди эта энергия соответствует поглощению в зеленой и голубой областях видимого спектра, для золота – в сине-фиолетовой, для серебра – в ближней ультрафиолетовой, что и объясняет появление окраски меди и золота. Золото и серебро встречаются как в самородном виде, так и в виде соединений. Крупные самородки металла, например найденный в 1869 г. в Австралии слиток золота массой 71 кг, встречаются крайне редко. Обычно золото образует мелкие зерна неправильной формы или тонкие пластинки, распределенные в породе или в россыпи. Мельчайшие пылевидные частицы золота встречаются в виде примеси в сульфидных рудах – пирите и халькопирите. Важнейшие минералы: Cu2S – халькозин («медный блеск»);
CuFeS2 – халькопирит; (СuОН)2СО3 – малахит; Cu2О – куприт; Ag2S – аргентит («серебряный блеск»); АuТе2 – калаверит; AuSb2 – ауростибит.
Получение
Богатые месторождения меди в основном выработаны, поэтому часто приходится извлекать Сu из бедных руд. Рeнтабельной является переработка руды, содержащей 0,2% Сu. Основными примесями медных руд являются кварц SiO2 и силикаты, а также соединения железа, главным образом FeS2. Пирометаллургические методы производства меди основаны на том, что оставшиеся после обогащения FeS2 и FeS окисляются кислородом легче, чем сульфиды меди Cu2S и CuS. Концентрат руды подвергают окислительной плавке. При этом происходят следующие процессы: окисление значительной части связанной с железом серы до диоксида серы (который направляют на получение H2SO4), переход Fe+2 в шлак Fe2SiO4, разложение FeS2 на FeS и серу (которая окисляется до SO2). Неокисленными остаются Cu2S и некоторое количество FeS. В результате в печи образуются два жидких слоя – сверху более легкий шлак, а внизу – расплав, состоящий из FeS и Cu2S. Шлак сливают, а FeS и Cu2S переливают в конвертер, в который добавляют флюс и вдувают воздух. В конвертере сульфид железа превращается в оксид, который переходит в шлак и образуется расплавленная медь: 2FeS + 3O2 = 2FeO + 2SO2; 2FeO + SiO2 = Fe2SiO4; 2Cu2S + 3O2 = 2Cu2O + 2SO2; 2Cu2O + Cu2S = 6Cu + SO2. Получаемая черновая медь, содержащая до 90,95% Сu, подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. На аноде черновая медь растворяется: Cu0 – 2е– = Сu2+ и на катоде снова выделяется: Сu2+ + 2е– = Сu0. Серебро получают как побочный продукт переработки медных и свинцово-цинковых сульфидных руд, но основной источник – это шламы электролитического рафинирования меди. В этом случае для отделения серебра от других металлов анодные шламы сначала обрабатывают горячей разбавленной азотной кислотой, затем нагревают с оксидом кальция или кремнеземом. Из нитратных растворов серебро с чистотой 99,9% выделяют электролизом. Серебро используют для изготовления серебряно-цинковых и серебряно-кадмиевых аккумуляторов, электрических контактов, зеркал и ювелирных изделий, в производстве фотопленки и фотобумаги. Руды, содержащие значительное количество серебра, подвергают после флотации прямой переработке для получения металла. В основе ее лежит цианидный процесс, заключающийся в растворении включений металла или сульфида в растворе цианида натрия при пропускании через него сжатого воздуха: 4Ag + 8NaCN + О2 + 2Н2О = 4Na[Ag(CN)2] + 4NaOH; Ag2S + 4NaCN = 2Na[Ag(CN)2] + Na2S. Из отфильтрованного раствора серебро выделяют цинковой пылью: 2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag.
Ag2S + 2NaCl + 2О2 2AgCl + Na2SО4. с последующим растворением хлорида серебра раствором тиосульфата натрия и восстановлением образующегося комплекса Na3[Ag(S2О3)2] цинковой пылью. Самородное золото отделяют от крупных кусков пустой породы путем промывки водой, поскольку его плотность (19,3 г/см3) намного выше плотности кварцевого песка (2,5 г/см3). Чистый металл получают цианидным методом или амальгамированием. В цианидном методе мелко раздробленную породу обрабатывают разбавленным щелочным раствором цианида натрия (рН 10–11) при непрерывном пропускании воздуха:
4Au + 8NaCN + О2 + 2Н2О = 4Na[Au(CN)2] + 4NaOH. Из цианидного раствора золото выделяют с помощью цинковой пыли: 2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au↓. Процесс занимает около 30 ч, общий выход золота достигает 90–95%. При выделении золота амальгамированием мелко раздробленную с помощью потока воды породу пропускают над медными пластинами, обработанными ртутью. Золото растворяется в ртути, которую затем удаляют дистилляцией. Полученное тем или иным способом золото отделяют от примесей электролитическим методом, что обеспечивает чистоту золота 99,99%. Химические свойства Серебро и золото не взаимодействуют с кислородом даже при высоких температурах. Медь взаимодействует с кислородом: 2Cu + O2 = 2CuO. Серебро вступает в реакцию с озоном и дает темно-коричневый оксид Ag2O: 2Ag + O3 = Ag2O + O2. С галогенами медь образует дигалогениды, серебро моногалогениды, золото тригалогениды и моногалогениды: Cu + Г2 = CuГ2 (Г = Cl, Br). Медь не взаимодействует со фтором из-за образования на поверхности слоя CuF2, препятствующего дальнейшему протеканию реакций, а с иодом дает только CuI. 2Cu + I2 = 2CuI. Легче всего медь, серебро, золото реагируют с бромом, образуя соответствующие галогениды. Золото с фтором медленно взаимодействует даже при 300–400°С, с хлором реакция протекает в температурном интервале 150–300°С, причем приболее низких температурах образуется AuCl3, а более высоких – AuCl. При взаимодействии с бромом при обычной температуре образуется смесь AuBr3 и AuBr выше 60°С – только AuBr. Золото и иод при 50–110°С дают АuI: Ag + Г2 = AgГ2 (Г = F, Cl, Br, I); 2Au + Г2 = 2AuГ (Г = F, Cl, Br, I); 2Au + 3Г2 = 2AuГ3 (Г = F, Cl, Br). CuI2 и AuI3 не образуются, так как Cu+2 и Au+3 проявляют окислительные свойства по отношению к ионам I–. При нагревании под давлением»1000 атм медь взамодействует с серой, образуя сульфид меди (I): 2Cu + S = Cu2S. Золото не взаимодействует с серой, хотя с теллуром образует соединения AuTe2. С фосфором металлы I В группы образуют фосфиды как стехиометрического, так и нестехиометрического состава Сu3Р, CuP2, Cu2P7, серебро – AgP2, Ag3P11, золото – AuP3, Au2P3. Азот и углерод не реагируют с металлами 1В группы даже при нагревании. Гидриды элементов I В группы (CuH2, AuH3) получают косвенными способами, они неустойчивы, разлагаются при комнатной температуре. Cu, Ag, Au имеют положительные значения стандартных электродных потенциалов, поэтому не вытесняют водород из воды и кислот-неокислителей.
Для перевода металлов в растворимое состоянии используют кислоты-окислители или реакции комплексообразования в присутствии окислителей. Медь легко реагирует как с концентрированной, так и с разбавленной азотной кислотой: Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O; Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4H2O, а также с другими кислотами-окислителями: 6Cu + 12HClO3 = 5Cu(ClO3)2 + CuCl2 + 6H2O, аналогично растворяется в хлорноватой кислоте и серебро: Ag + 6HClO3 = 5AgClO3 + AgCl¯ + 3H2O. Серебро хорошо растворяется концентрированной азотной кислотой: Ag + 2HNO3(конц) = AgNO3 + NО2 + H2O. Cu взаимодействует с концентрированной серной кислотой: Cu + 2H2SO4(конц) Образование малорастворимого Ag2SO4 препятствует быстрому растворению серебра даже в горячем концентрированном растворе серной кислоты: 2Ag + H2SO4(конц) = Ag2SO4 + SO2 + 2H2O. Образование малорастворимых и комплексных соединений приводит к понижению потенциала Cu+/ Cu и увеличению восстановительной активности. Это объясняет растворение меди в водных растворах цианидов, а при рН = 0 в растворах галогеноводородных кислот: 2Cu + 6KCN + 2H2O = 2K2[Cu(CN)3] + KOH + H2; Cu + 4HГ = 2H[CuГ2] + H2 (Г = Cl–, Br–, I–). В отличие от меди, серебро и золото могут растворяться в растворах цианидов только в присутствии окислителя Н2О2 или О2: Au + 8KCN + О2 + 2H2O = 4Na[Au(CN)2] + 4NaOH. В присутствии кислорода воздуха медь медленно вступает в реакцию с аммиаком: 2Cu + 8NН3 + О2 + 6H2O = 2[Cu(NH3)4(H2O)2](OH)2. Потемнение серебряных изделий во влажном воздухе, содержащем сероводород или другие соединения, объясняется образованием черного Ag2S: 4Ag + 2H2S + О2 = 2Ag2S¯ + 2H2O. В этом случае из-за низкой растворимости Ag2S стандартный окислительно-восстановительный потенциал Мелкодисперсное металлическое серебро можно растворить в присутствии окислителя в плавиковой кислоте, что приводит к образованию раствора AgF: 2Ag + 2HF + H2O2 = 2AgF + 2H2O. Золото устойчиво к действию азотной и серной кислот, но селеновая кислота его растворяет, его также растворяют в смеси азотной и соляной кислот («царская водка») 2Au + 6H2SeO4 (конц) = Au2(SeO4)3 + 3SeO2 + 6H2O; Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O. Золото можно растворить в концентрированной соляной кислоте, насыщенной хлором: 2Au + 2HCl + 3Cl2 = 2H[AuCl4]. По отношению ко многим другим реагентам золото устойчиво, что позволяет назвать его «благородным металлом». При длительном хранении меди на воздухе образуется зеленый налет (CuOH)2CO3 и (CuOH)2SO4: 2Cu + О2 + 2H2O + CО2 = 2(CuOH)2CO3; 4Cu + 5/2О2 + 3H2O + SО2 = 2Cu(OH)2 × (CuOH)2SO4. Соединения d -элементов I группы Все d -элементы I группы образуют оксиды Ме2О, проявляющие основные свойства. Ме2О неустойчивы, при нагревании выше 100оС Cu2O превращается в CuO, а оксиды серебра (I) и золота (I) разлагаются даже при слабом нагревании: Cu2O 2Ag2O Ме2О растворяются в соляной кислоте с образованием хлоридов. При избытке HCl образуют комплексы: Cu2O + 4HCl = 2H[CuCl2] + H2O. Комплексообразование позволяет переводить оксиды металлов в раствор: Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH; Ag2O + 4KI + H2O = 2K[AgI2] + 2KOH; Au2O + 4KCN + H2O = 2K[Au(CN)2] + 2KOH.
Так как степень окисления +1 является для серебра устойчивой, то растворение Ag2О в кислотах HNO3 и H2SO4 не приводит к изменению его степени окисления. Cu2O в разбавленной серной кислоте диспропорционирует: Cu2O + H2SO4(разб) = Cu + CuSO4 + H2O. Оксид золота (I) при взаимодействии с кислородсодержащими кислотами также диспропорционирует превращаясь в ацидокомплексы золота (III): Au2O + 2H2SO4 = Au + H[Au(SO4)2] + H2O. Оксиды серебра (I) и золота (I) проявляют сильные окислительные свойства: Ag2O + H2O2 = 2Ag¯ + H2O + О2. Получают оксид серебра (I) по реакции: 2AgNO3 + 2NaOH = Ag2O¯ + 2NaNO3 + H2O. Оксид меди (I) получают из свежеосажденного гидроксида, восстанавливая его разными восстановителями: альдегидом, глюкозой, гидразином: 2Cu(OH)2 + HCOH 2CuSO4 + 5NaOH + C6H12O6 4CuSO4 + 8NaOH + N2H4 = 2Cu2O + N2 + 4Na2SO4 + 6H2O или действием щелочи на хлоридные комплексы меди (I). Аналогично могут быть получены оксиды серебра (I), золота (I): 2H[AuCl2] + 4NaOH = Au2O + 4NaCl + 3H2O. Из оксидов МеО устойчив только CuO (черный). У оксида CuO преобладают основные свойства, он растворяется в кислотах H2SO4, НNO3 и других с образованием солей: CuO + H2SO4 = CuSO4 + H2O. Слабый амфотерный характер проявляется при сплавлении со щелочами, при этом образуются купраты: 2NaOH + CuO = Na2CuO2 + H2O, а при кипячении в концентрированных растворах щелочей образуется темно-синий комплекс: CuO + 2NaOH + H2O За счёт комплексообразования CuO растворяется в растворе аммиака: CuO + 4NH3 + H2O = [Cu(NH3)4](OH)2. Оксид CuO проявляет окислительные свойства по отношению к таким восстановителям, как Н2, СО, С, NH3: CuO + СО 3CuO + 2NH3 Получают CuO разложением основного карбоната, нитрата или гидроксида при нагревании: (CuOH)2СО3 2Cu(NO3)2 × 3H2O Cu(OH)2 Оксиды Ме2О3 известны для всех d -элементов I группы. Cu2O3 (гранатово-красный) синтезируют, окисляя Cu(ОН)2 гипохлоритом натрия или пероксосульфатом калия в щелочной среде: 2Cu(ОН)2 + K2S2O8 + 2KOH ® Cu2O3¯ + 2K2SO4 + 3H2O. Сведения о свойствах Ag2O3 в литературе практически отсутствуют. Au2O3 получают осторожным обезвоживанием гидроксида Аu(ОН)3 при 100°С: AuCl3 + 3NaOH 2AuO(OH) –H2O при более высоких температурах Au2O3 разлагается: 2Au2O3 Оксид Au2O3 и отвечающий ему гидроксид являются амфотерными соединениями. Гидроксиды металлов I В группы неустойчивы, поэтому практического значения не имеют. CuОН – желтого цвета, легко переходит в Cu2O; AgОН – существует только в сильно разбавленных растворах, Наиболее устойчив гидроксид Cu(ОН)2 – слабоамфотерный гидроксид с преобладанием основных свойств: Cu(ОН)2¯ + H2SO4 = CuSO4 + 2H2O. В концентрированных растворах щелочей образует ярко-синие тетрагидроксокупраты: Cu(ОН)2¯ + 2NaOH = Na2[Cu(OH)4]. Тетрагидроксокупраты выделены в кристаллическом состоянии, а при твердофазном синтезе получены купраты Sr2CuO3, Ba2CuO3 и др. Гидроксид золота (III) состава Au2O3 × х H2O (желто-коричневого цвета) условно записывают в виде Аu(ОН)3, реагирует со щелочами c образованием тетрагидроксоауратов (III): Аu(ОН)3 + KOH = K[Au(OH)4]. Кислотные свойства Аu(ОН)3 преобладают над основными. Аu(ОН)3 взаимодействует с сильными кислотами, образуя анионный комплексы: Аu(ОН)3 + 4НNO3 = Н[Au(NO3)4] + 2H2O. При хранении или слабом нагревании медленно теряют воду: Аu(ОН)3 ® АuО(ОН) ® Аu2О3. Медь, серебро, золото образуют огромное количество комплексных соединений, как простых, так и достаточно сложных, например: Na2[CuCl4], [Cu(NH3)4](OH)2, Na3[Сu(S2O3)2], [Сu(NH3)2]2SO4, [Ag(NH3)2]Cl, H[Au(OH)Cl3], H[AuCl4], Ва[Au(ОН)4]2 · 5H2O. Соли. Степень окисления +1 устойчива в водных растворах только для серебра, поэтому известно много солей Ag (I) с различными анионами. Однако большинство солей не растворимы в воде, растворимы AgNO3, AgCH3COO, AgClO3, AgClO4 и AgF. Все соли серебра чувствительны к свету, поэтому чернеют на свету, восстанавливаясь до серебра. При нагревании разлагаются: Ag2SO4 AgClO4 Благодаря окислительным свойствам иона Ag+ (Е Для Cu (I) и Au (I) известны сульфиды Cu2S, Au2S, а также моногалогениды (кроме CuF). Так как степень окисления +2 для меди наиболее характерна, Ион Cu2+ в водных растворах существуют в виде гексааквакомплекса [Cu(H2O)6]2+, который входит в состав многих кристаллогидратов: Cu(NO3)2 × 6H2O, Cu(ClO4)2 × 6H2O и т.д. Среди солей меди (II) наибольший интерес представляет медный купорос CuSО4 × 5H2O, встречающийся в природе в виде сине-голубых кристаллов, продуктов окисления сульфидных руд. Он используется для нанесения медных покрытий, консервации древесины, защиты растений от болезней. Известно также много фосфатов меди, получены как кислые, так и основные фосфаты. Некоторые из них имеют изумрудно-зеленый цвет и используются в качестве зеленых пигментов. Слабые основные свойства гидроксида меди (II) не позволяют синтезировать в водном растворах со слабыми кислотами некоторые средние соли, например карбонаты. В результате взаимодействия растворов, содержащих медь (II) и карбонат натрия, образуются аморфные голубые осадки гидратированного основного карбоната меди (CuOH)2CO3 × n H2O. При стоянии и слабом нагревании осадок обезвоживается, превращаясь в светло-зеленый аморфный порошок (CuOH)2CO3, соответсвующий по составу минералу малахиту. CuCO3 получают взаимодействием оксида, гидроксида или гидроксокарбоната меди с углекислым газом при высоком давлении: (CuOH)2CO3 + CO2 Степень окислениия +3 наиболее характерна для золота. Для Простые соли меди (III) неизвестны, однако степень окисления +3 стабилизируется в комплексных соединениях, например: K[Cu(OH)4], K[CuF4]. Из солей серебра (III) известен лишь фторид AgF3 – сильнейший окислитель. Биогенная роль d -элементов I В группы Медь Сu – необходимый микроэлемент живых организмов. Серебро Аg и золото Аu – примесные микроэлементы. Их соединения применяют в медицине. Медь – биогенный элемент, содержится в тканях животных и растений. Общая масса меди в организме взрослого человека примерно 100 мг. Примерно 30% этого количества содержится в мышцах. Печень и мозг также богаты медью. Металлическая медь и ее соединения токсичны. Наиболее важными с физиологической точки зрения являются медьсодержащие белки, обеспечивающие клеточное дыхание, восстанавливая кислород до воды на конечном участке дыхательной цепи. Интересно, что переносчиком кислорода у моллюсков и членистоногих является не гемоглобин, а гемоцианин (медьсодержащие комплексы). Кровь этих животных имеет голубой цвет. Ежедневно организму требуется 2,5–5,0 мг меди. При недостатке в организме меди может развиваться болезнь – медьдефицитная анемия. Медь необходима для усвоения железа, при дефиците меди нарушается нормальное развитие соединительных тканей и кровеносных сосудов. Широкое применение меди и ее соединений в промышленности и сельском хозяйстве повышает риск отравления этими веществами. Отравления обычно связаны со случайной передозировкой инсектицидов, вдыханием порошка металла, заглатыванием растворов солей меди. Большую опасность представляют напитки, хранящиеся в медных сосудах без защитного покрытия стенок. Токсическое действие соединений меди обусловлено тем, что ионы меди взаимодействуют с тиольными –SН-группами и аминогруппами –NH2 белков. Вследствие таких взаимодействий белки становятся нерастворимыми, теряют ферментативную активность. В результате нарушается нормальная жизнедеятельность. В качестве наружного средства применяют 0,25%-ный водный раствор сульфата меди СuSО4 при воспалении слизистых оболочек и конъюнктивитах. Малые дозы этого препарата могут применяться во время приема пищи при малокровии. В организме взрослого человека обнаруживается около 1 мг серебра и до 10 мг золота. Антисептические свойства растворимых солей серебра известны с древних времен. Священнослужители давно знали, что вода («святая») при хранении в серебряных сосудах долго не портится, т. е. не подвергается микробному загрязнению. В настоящее время это свойство «серебряной» воды используется моряками в дальних плаваниях. Сильные токсические проявления у взрослого человека наблюдаются при приеме внутрь 7 г АgNO3. Токсическое действие соединений серебра, как и в случае меди, обусловлено главным образом тем, что ионы серебра взаимодействуют с тиольными серо- и азотсодержащими группами белков, нуклеиновых кислот и других биоорганических веществ. В водном растворе существуют только комплексные соли золота, например, Nа3[Аu(S2О3)2] и различные тиоловые бионеорганические комплексы. Механизм токсического действия соединений золота аналогичен механизму токсического действия соединений меди и серебра. В соответствии с общим правилом для тяжелых металлов одной группы токсичность возрастает с увеличением атомного номера в ряду: Сu‒Аg‒Аu. В медицине издавна используются такие препараты, как кристаллический нитрат серебра АgNО3 (ляпис) и его водные растворы. Давно известны также препараты коллоидного металлического серебра протаргол (8% Аg) и колларгол (70% Аg), которые представляют собой мелкодисперсные порошки с металлическим блеском. Каждая частица таких порошков представляет собой кристаллик восстановленного металлического серебра размером менее 1 мкм с белковой оболочкой из альбумина (протаргол) или коллагена (колларгол). Белковая оболочка защищает кристаллики серебра от слипания и обеспечивает их переход в водную среду. Препараты серебра применяют как противовоспалительные, антисептические и вяжущие средства. В качестве эффективных противовоспалительных средств применяют также препараты золота. Наиболее известны кризанол (от греч. хризос – золото) с 30%-ным содержанием благородного металла и коллоидное золото.
Применение d -элементов I B -группы На основе меди разработано большое число сплавов, к важнейшим из которых относятся латуни, бронзы и мельхиор. Латуни – медно-цинковые сплавы, содержащие до 50% цинка. Латуни по внешнему виду напоминают золото. Они дешевле бронз, легко обрабатываются, плавятся при температуре ниже температуры плавления меди, характеризуются высокой коррозионной стойкостью. При хранении на влажном воздухе латунные изделия тускнеют, но сам сплав при этом не разрушается. Латуни используют в кораблестроении, приборостроении, из них изготавливают гильзы патронов, трубы, краны, вентили. Бронза – сплав меди с каким-либо другим металлом, за исключением цинка и никеля. Наиболее известны и распространены оловянные бронзы, содержащие около 10% олова. Сплав с 10–15% олова имеет золотисто-коричневый («бронзовый») цвет. При содержании олова 16–25% сплав становится бледно-желтым, при 26–33% олова – светло-серым. При еще большем содержании олова получают так называемую белую бронзу, по цвету напоминающую серебро. В «пушечной бронзе» около 85% меди, 5% цинка, 5% олова и 5% свинца. Колокольный металл содержит 78–80 % меди и 20–2 % олова. Корабельные винты делают из марганцевой бронзы, содержащей до 30% марганца. Помимо оловянистых бронз, в которых основным легирующим элементом служит олово, выпускают прочные сплавы меди с алюминием, бериллием, германием, кадмием, свинцом и некоторыми другими металлами, также называемые бронзами (безоловянистые, специальные бронзы). Безоловянистые бронзы отличаются высокой механической прочностью, коррозионной стойкостью. Они недостаточно устойчивы к окислению при нагревании, но очень стойки на воздухе и в морской воде. Мельхиор – медно-никелевый сплав, содержащий 29–33% никеля. Он обладает высокой коррозионной устойчивостью – не разрушается даже при длительном воздействии водяного пара, морской воды, щелочей. Мельхиор исрользуют для изготовления столовой посуды, в приборостроении. Медь, серебро, золото называют «монетными металлами», поскольку в древние времена их использовали как деньги, а позже из их сплавов чеканили монеты. Массовое содержание благородных металлов в сплавах характеризуют «пробой», значение которой соответствует содержанию драгоценного металла в 1000 г сплава. Ювелирные украшения часто имеют пробу по золоту 583, по серебру ‒ 875. Международный стандарт для производства золотых и серебряных монет – 900-ая проба.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 40; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.122.4 (0.118 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Увеличение
Увеличение , В
, В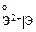 , В
, В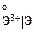 , В
, В В другом методе переработки сульфидной руды используют хлорирующий обжиг:
В другом методе переработки сульфидной руды используют хлорирующий обжиг: CuSO4 + SO2 + H2O.
CuSO4 + SO2 + H2O. = –0,65 В, что намного ниже Е
= –0,65 В, что намного ниже Е  = 0,799 В, и реакция становится возможной.
= 0,799 В, и реакция становится возможной. Cu2O + HCOOH+ 2H2O;
Cu2O + HCOOH+ 2H2O; 2CuCO3 + Н2О.
2CuCO3 + Н2О.


