
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пути катаболизма безазотистого остатка аминокислот. Значение этого процесса.Содержание книги
Поиск на нашем сайте
Обмен безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Синтез глюкозы из аминокислот. Синтез аминокислот из глюкозы. В ходе катаболизма аминокислот происходит отщепление аминогруппы и выделение аммиака. Другим продуктом дезаминирования аминокислот служит их безазотистый остаток в виде α-кетокислот. Катаболизм аминокислот происходит практически постоянно. За сутки в норме в организме человека распадается примерно 100 г аминокислот, и такое же количество должно поступать в составе белков пищи. Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируваткиназы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2 и Н2О с выделением энергии. Такой путь проходят преимущественно аминокислоты пищи. При недостатке глюкозы в организме фосфоенолпируват включается в глюконеогенез. Это происходит при голодании, длительной физической работу при сахарном диабете и других тяжёлых хронических заболеваниях, сопровождающихся распадом собственных белков организма. Скорость глюконеогенеза из аминокислот регулируется гормонами. Так, под действием глюкагона увеличивается активность регуляторных ферментов процесса, а кортизол индуцирует синтез ферментов глюконеогенеза в печени. Активация глюконеогенеза из аминокислот происходит и при преимущественно белковом питании. Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат. Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот. Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными. Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или гликокетогенными. В условиях голодания часть белков мышечной ткани распадается до аминокислот, которые далее включаются в процесс катаболизма. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз. В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Углеродный скелет этих аминокислот образуется из глюкозы. α-аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования. Универсальным донором α-аминогруппы служит глутамат. Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты. 76.Реакции образования и обезвреживания аммиака в организме человека. Причины гипераммониемии. 1. Основным источником аммиака является катаболизм аминокислот в тканях. Небольшая часть аммиака образуется в клетках при распаде азотсодержащих соединений (биогенных аминов, нуклеотидов и др.) (рис. 9.7), а также при гниении белков в кишечнике в результате деятельности микрофлоры, откуда он частично всасывается и поступает в воротную вену. Концентрация аммиака в крови воротной вены существенно выше, чем в общем кровотоке. Катаболизм аминокислот и образование аммиака происходит во всех тканях организма. Однако концентрация аммиака в крови очень мала, так как он быстро связывается в клетках с образованием нетоксичных продуктов. Содержание аммиака в крови в норме составляет всего 0,4-0,7 мг/л (25-40 мкмоль/л). Из организма аммиак выводится почками в виде конечных продуктов азотистого обмена: • мочевины - синтезируется в печени; • аммонийных солей - образуются в почках.
2. В разных тканях существует несколько способов связывания и выведения аммиака (рис. 9.8). Основной реакцией обезвреживания аммиака почти во всех тканях является синтез глутамина под действием глутаминсинтетазы:
Глутамин можно считать транспортной формой аммиака, он является нейтральной аминокислотой и способен легко проникать через клеточные мембраны путем облегченной диффузии (в отличие от глутамата, требующего механизмов активного транспорта). Глутамин поступает в кровь из многих органов, в наибольшем количестве - из мышц и мозга (см. рис. 9.8). 3. Из тканей глутамин транспортируется в почки и кишечник. В клетках кишечника под действием фермента глутаминазы происходит отщепление амидной группы в виде NH3 а образовавшийся глутамат с помощью АЛТ превращается в аланин.
4. В почках глутамин также подвергается действию фермента глутаминазы и расщепляется на глутамат, который реабсорбируется и возвращается в клетки тканей, и аммиак (см. рис. 9.8, В).
А - выведение азота из мышц и кишечника в составе аланина и глутамина; Б - выведение азота из мозга и мышц в виде глутамина; В - экскреция аммиака из почек в виде аммонийных солей; Г - включение азота аминокислот в мочевину в печени Глутаминаза почек активируется при ацидозе; образовавшийся аммиак используется для нейтрализации кислых продуктов и образования аммонийных солей [в основном, NH4Cl, (NH4)2SO4], которые экскретируются с мочой (рис. 9.9). Экскреция солей аммония в норме составляет -0,5 г/сут, при ацидозе выведение аммонийных солей может увеличиться до 10 г/сут. Этот путь выведения аммиака: • поддерживает кислотно-щелочной баланс в норме; • защищает организм от потери с мочой ионов Na+ и К+, которые также могут использоваться для выведения избытка анионов.
5. В мозге и некоторых других органах для обезвреживания аммиака используется реакция восстановительного аминирования α-кетоглутарата под действием глутаматдегидрогеназы, которая катализирует реакцию, обратную окислительному дезаминированию глутамата. Однако этот путь в тканях используется слабо. Хотя, если учитывать возможность последующего образования глутамина, он является выгодным для клеток, так как способствует обезвреживанию сразу двух молекул NH3:
где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается в процессе синтеза мочевины, а пируват включается в глюконеогенез или ОПК. Глюкоза из печени поступает в ткани и в процессе гликолиза окисляется до пирувата. Образование аланина в мышцах, его перенос в печень и перенос глюкозы в обратном направлении составляют глюкозоаланиновый цикл (см. рис. 9.8, А, Г). 7. В печени аммиак обезвреживается путем связывания с СО2 и образования карбамоилфосфата (см. рис. 9.8, Г). Реакцию катализирует карбамоилфосфатсинтетаза I, которая использует 2 моль АТФ. Фермент локализован в митохондриях гепатоцитов. Продукт реакции - карбамоилфосфат - включается затем в орнитиновый цикл Кребса-Гензелейта для синтеза мочевины.
|
|||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 193; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.63.176 (0.007 с.) |

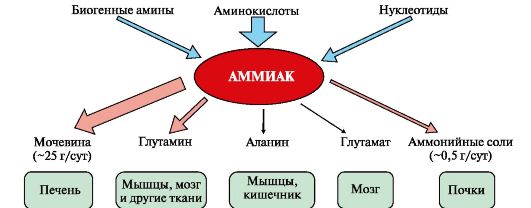 Рис. 9.7. Источники аммиака и пути его превращения в разных тканях
Рис. 9.7. Источники аммиака и пути его превращения в разных тканях Глутаминсинтетаза обладает высоким сродством к аммиаку и благодаря этой реакции в крови и тканях поддерживается низкая концентрация NH3.
Глутаминсинтетаза обладает высоким сродством к аммиаку и благодаря этой реакции в крови и тканях поддерживается низкая концентрация NH3.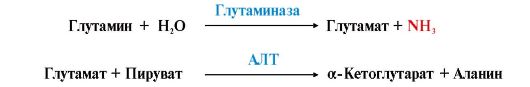 Таким образом, в энтероцитах амидная группа глутамина превращается в аммиак, а аминогруппа глутамина - включается в состав аланина.
Таким образом, в энтероцитах амидная группа глутамина превращается в аммиак, а аминогруппа глутамина - включается в состав аланина.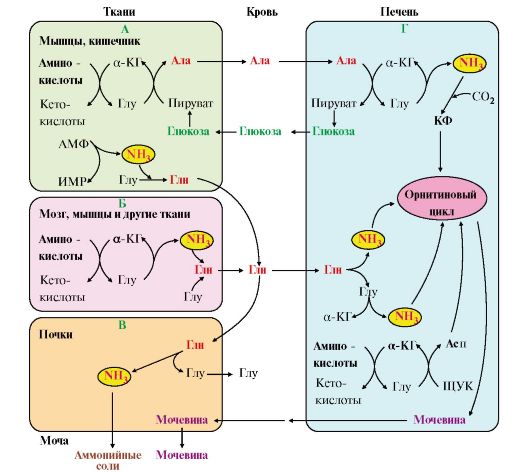 Рис. 9.8. Пути обмена азота аминокислот и аммиака:
Рис. 9.8. Пути обмена азота аминокислот и аммиака: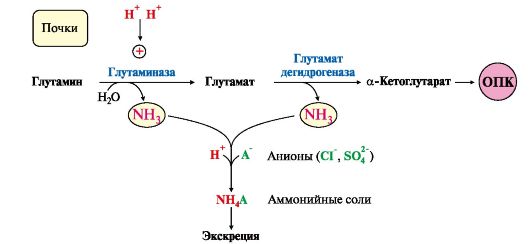 Рис. 9.9. Использование глутамина в почках для поддержания кислотно-щелочного баланса
Рис. 9.9. Использование глутамина в почках для поддержания кислотно-щелочного баланса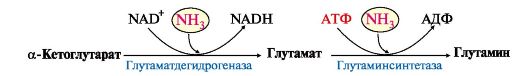 6. Из мышц, клеток кишечника и некоторых других тканей избыток азота выводится в кровь в виде аланина (см. рис. 9.8, А, Г). Образование аланина в этих органах можно представить следующей схемой:
6. Из мышц, клеток кишечника и некоторых других тканей избыток азота выводится в кровь в виде аланина (см. рис. 9.8, А, Г). Образование аланина в этих органах можно представить следующей схемой: Аминогруппы разных аминокислот в ходе реакций трансаминирования переносятся на пируват, источником которого служат глюкоза и безазотистые остатки аминокислот. Особенно много аланина выделяют мышцы в силу их большой массы, а также потому, что работающие мышцы часть энергии получают за счет распада аминокислот. Аланин поступает в печень,
Аминогруппы разных аминокислот в ходе реакций трансаминирования переносятся на пируват, источником которого служат глюкоза и безазотистые остатки аминокислот. Особенно много аланина выделяют мышцы в силу их большой массы, а также потому, что работающие мышцы часть энергии получают за счет распада аминокислот. Аланин поступает в печень,


