
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обмен фенилаланина и тирозина. Использование тирозина для синтеза катехоламинов, тироксина и меланинов. Распад тирозина.
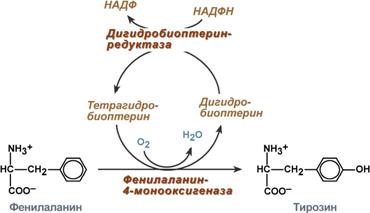
Обмен фенилаланина и тирозина Фенилаланин относится к незаменимым аминокислотам, поскольку ткани животных не обладают способностью синтезировать его бензольное кольцо. В организме фенилаланин используется только в синтезе белков, весь неиспользованный запас аминокислоты превращается в тирозин. В этом непосредственно участвует фермент фенилаланин-4-монооксигеназа (фенилаланингидроксилаза), обеспечивающий окисление ароматического кольца. Кофермент тетрагидробиоптерин в реакции окисляется до дигидроформы. Восстановление кофермента осуществляет дигидробиоптерин-редуктаза с своим коферментом НАДФН.
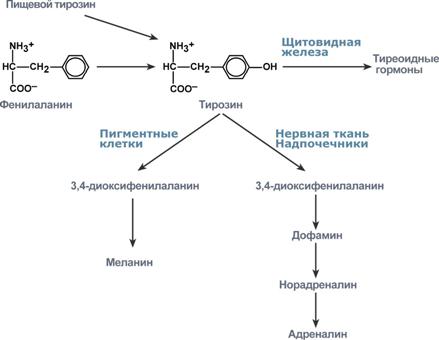
Реакция превращения фенилаланина в тирозин Тирозин, помимо участия в синтезе белков, является предшественником гормона надпочечников адреналина, медиаторов норадреналина и дофамина, гормонов щитовидной железы тироксина и трийодтиронина и пигмента меланина.
Пути превращения тирозина Тирозин — заменимая аминокислота, в организме животных и человека образуется при ферментативном окислении фенилаланина (нарушение этого процесса приводит к тяжёлому наследственному заболеванию — фенилпировиноградной олигофрении). Окисление Тирозин ферментом тирозиназой — важная промежуточная реакция при биосинтезе меланинов, норадреналина и адреналина у человека. Иодированные производные Тирозин — тироксин и трииодтиронин — гормоны щитовидной железы.Важную роль играет Тирозин как предшественник при биосинтезе алкалоидов (морфин, кодеин, папаверин). Ферментативное окисление L-T. используют для получения медицинского препарата — L- ДОФА. При распаде Тирозин в организме (с участием аскорбиновой кислоты) образуются фумаровая и ацетоуксусная кислоты, которые через ацетилкофермент А включаются в трикарбоновых кислот цикл. 81.Наследственные нарушения обмена аминокислот (на примере фенилаланина и тирозина). Метаболизм фенилаланина, тирозина и гистидина в разных тканях приводит к образованию различных биологически активных соединений. Дефекты ферментов обмена этих аминокислот проявляются как наследственные заболевания (энзимопатии). 1. В печени фенилаланин метаболизируется двумя путями. Большая часть не использованного для синтеза белков Фен (до 80%) превращается в тирозин
под действием фермента фенилаланингидроксилазы при участии кофермента тетрагидробиоптерина. Небольшое его количество включается в альтернативный путь:
• классическая - наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы. Наиболее тяжелое проявление - нарушение умственного и физического развития, судорожный синдром; • вариантная (биоптеринзависимая гиперфенилаланинемия) - следствие мутаций в генах, контролирующих метаболизм тетрагидробиоптерина (см. рис. 9.22). Клинические проявления - близкие, но не совпадающие с классической ФКУ. Тяжелые проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации Фен ограничивают транспорт Тир и Три через гематоэнцефалический барьер и тормозят синтез нейромедиаторов. Тетрагидробиоптерин (Н4БП) необходим для реакций гидроксилирования не только Фен, но также Тир и Три, поэтому при недостатке этого кофермента нарушается метаболизм всех трех аминокислот, в том числе синтез нейромедиаторов - катехоламинов и серотонина. Заболевание характеризуется тяжелыми неврологическими нарушениями и ранней смертью (злокачественная ФКУ). 2. Нарушение катаболизма Тир в печени на стадии расщепления гомогентизиновой кислоты приводит к алкаптонурии («черная моча»). Для этого заболевания характерно выделение с мочой гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует черные пигменты - алкаптоны. Алкаптоны способны откладываться в хрящевой ткани и суставах, что вызывает артриты и охроноз (черные пятна). Болезнь врожденная, связана с дефектом фермента диоксигеназы гомогентизиновой кислоты. 3. Наследственный дефект тирозиназы - фермента, катализирующего в меланоцитах превращение тирозина в ДОФА, вызывает нарушение синтеза темных пигментов меланинов, которое приводит к альбинизму. Основным клиническим проявлением альбинизма (от лат. albus - белый) являются отсутствие пигментации кожи и волос. У больных часто снижается острота
зрения и появляется светобоязнь. Длительная инсоляция таких больных приводит к ожогам и раку кожи. 4. Недостаточность дофамина в черной субстанции мозга приводит к болезни Паркинсона. Это одна из самых распространенных неврологических болезней (частота встречаемости 1:200 среди людей старше 60 лет). Характеризуется снижением активности тирозингидроксилазы или ДОФА-декарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор конечностей (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер, поэтому для лечения паркинсонизма используются следующие подходы: • заместительная терапия препаратами - предшественниками дофамина (производными ДОФА) - леводопа, мадопар, наком и др.; • подавление инактивации дофамина ингибиторами МАО - депренил, ниаламид, пиразидол и др. 5. Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина. Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении. 82.Декарбоксилирование аминокислот. Биогенные амины (гистамин, серотонин, ГАМК, катехоламины) образование, значение. 1. Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению α-карбоксильной группы. Продуктами реакции являются СО2 и биогенные амины (табл. 9.7). Образование биогенных аминов происходит с участием ферментов декарбоксилаз в присутствии кофермента пиридоксальфосфата.
2. В нервных клетках декарбоксилирование глутамата приводит к образованию γ-аминомасляной кислоты (ГАМК), которая является основным тормозным медиатором. Инактивации ГАМК происходит либо путем трансаминирования и превращения в сукцинат, являющийся метаболитом ЦТК, либо окислительным путем под действием моноаминооксидазы (МАО) (рис. 9.25).
ГАМК в виде препаратов гаммалон или аминалон применяют при нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга. 3. В нервной ткани из серина синтезируется ацетилхолин, который также относится к биогенным аминам:
4. Серотонин - нейромедиатор проводящих путей, образуется в гипоталамусе, надпочечниках из аминокислоты триптофана:
5. К биогенным аминам относятся и катехоламины (дофамин, норадреналин и адренамин) (см. рис. 9.23, В). Таблица 9.7. Биологическая роль и предшественники некоторых биогенных аминов
• метилирование с участием SAM под действием метилтрансфераз - характерно для гистамина, адреналина, норадреналина:
При окислении биогенных аминов происходит дезаминирование и образование альдегида, а затем кислоты, которые выводятся почками:
|
|||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 208; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.72.224 (0.011 с.) |
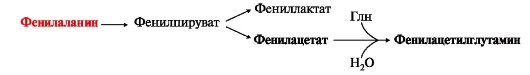 Конъюгат фенилацетата с глутамином выводится с мочой. При нормальной активности фенилаланингидроксилазы этот путь не имеет большого значения. Он становится главным при нарушении превращения фенилаланина в тирозин. Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурии (ФКУ). Известны две формы заболевания:
Конъюгат фенилацетата с глутамином выводится с мочой. При нормальной активности фенилаланингидроксилазы этот путь не имеет большого значения. Он становится главным при нарушении превращения фенилаланина в тирозин. Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурии (ФКУ). Известны две формы заболевания: Биогенные амины являются биологически активными веществами, выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК), гормонов (адреналин), регуляторных факторов местного действия (гистамин).
Биогенные амины являются биологически активными веществами, выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК), гормонов (адреналин), регуляторных факторов местного действия (гистамин). Рис. 9.25. Схема синтеза и инактивации ГАМК
Рис. 9.25. Схема синтеза и инактивации ГАМК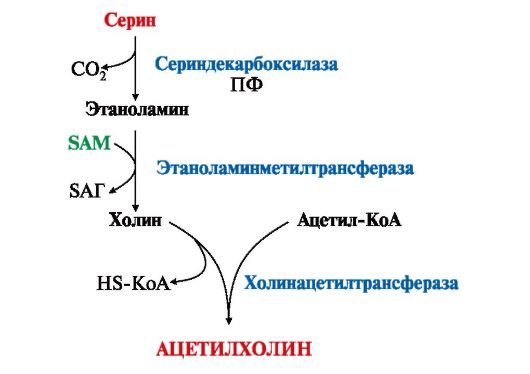 Нарушение образования ацетилхолина в синапсах может вызвать миастению - мышечную слабость.
Нарушение образования ацетилхолина в синапсах может вызвать миастению - мышечную слабость.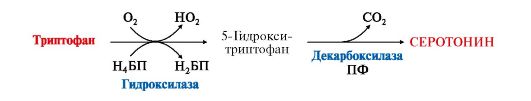 Серотонин представляет собой биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, перистальтику кишечника, оказывает сосудосуживающий эффект, регулирует артериальное давление, температуру тела, дыхание, обладает антидепрессантным действием («гормон удовольствия»), принимает участие в аллергической реакции, поскольку в небольших количествах синтезируется в тучных клетках.
Серотонин представляет собой биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, перистальтику кишечника, оказывает сосудосуживающий эффект, регулирует артериальное давление, температуру тела, дыхание, обладает антидепрессантным действием («гормон удовольствия»), принимает участие в аллергической реакции, поскольку в небольших количествах синтезируется в тучных клетках.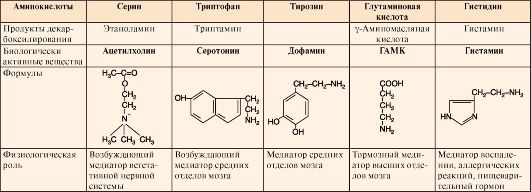 6. Инактивация биогенных аминов происходит двумя путями:
6. Инактивация биогенных аминов происходит двумя путями: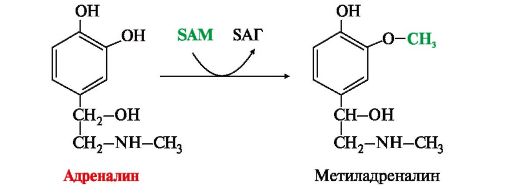 окисление ферментами моноаминооксидазами (МАО) с коферментом FAD - характерно для дофамина, норадреналина, серотонина, ГАМК.
окисление ферментами моноаминооксидазами (МАО) с коферментом FAD - характерно для дофамина, норадреналина, серотонина, ГАМК.



