
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Катаболизм пуриновых нуклеотидов. Представления о биосинтезе пуриновых нуклеотидов. Подагра.Содержание книги
Поиск на нашем сайте
1. Реакции образования пуриновых нуклеотидов начинаются с синтеза 5-фосфорибозил-1-дифосфата (ФРДФ), являющегося общим донором фосфорибозы в синтезе пуриновых и пиримидиновых нуклеотидов. ФРДФ образуется из рибозо-5-фосфата и АТФ в реакции, катализируемой ФРДФ-синтетазой:
В этом метаболическом пути свободное азотистое основание не образуется, а пуриновое кольцо формируется на остатке рибозо-5-фосфата при участии глицина, амидного азота Глн, а-NН2-группы Асп, СО2 и одноуглеродных производных: метенил- и формил-Н4-фолата (рис. 10.1).
Синтез первого пуринового нуклеотида - инозин-5'-монофосфата (ИМФ) включает 10 стадий и идет с затратой шести молекул АТФ. Все реакции протекают в цитозоле большинства клеток организма. Двумя последовательными реакциями ИМФ может превращаться в АМФ или ГМФ соответственно (рис. 10.2). Регуляторной и скорость-лимитирующей стадией процесса является перенос амидной группы Глн на ФРДФ с образованием 5-фосфорибозил-1- амина, которую катализирует ФРДФ-амидофосфорибозилтрансфераза. Ткани, не способные к синтезу пуринов: эритроциты, полиморфноядерные лейкоциты и частично мозг - обеспечиваются нуклеотидами за счет их синтеза в печени. 3. Синтез нуклеозиддифосфатов (НДФ) и нуклеозидтрифосфатов (НТФ) происходит при участии АТФ и ферментов нуклеозидмонофосфат- или нуклеозиддифосфаткиназ (НМФ- и НДФ-киназы соответственно) (рис. 10.3).
Перенос амидной группы Глн на ФРДФ и образование 5-фосфорибозил-1-амина катализирует ФРДФ-амидофосфорибозилтрансфераза. Затем с аминогруппой 5-фосфорибозил-1-амина последовательно взаимодействуют остаток Гли, N5N10- метенил-Н4-фолат, еще одна амидная группа Глн, диоксид углерода, аминогруппа Асп и формильный радикал N10-формил-Н4-фолата. Синтезируется первый пуриновый нуклеотид - инозин-5'-монофосфат (ИМФ). На этом этапе метаболический путь раздваивается и ИМФ становится общим предшественником АМФ и ГМФ, каждый из которых получается в двух последовательных реакциях. В процессе синтеза АМФ из ИМФ используется энергия молекулы ГТФ, а при синтезе ГМФ - энергия АТФ. ФРДФ-амидофосфорибозилтрансфераза, аденилосукцинатсинтетаза и ИМФ-дегидрогеназа - аллостерические ферменты, и их активность регулируется по механизму отрицательной обратной связи
4. Регуляция процесса. АМФ, ГМФ, ИМФ, ди- и трифосфаты адениловых и гуаниловых нуклеотидов ингибируют ключевые реакции своего синтеза аллостерически по механизму отрицательной обратной связи. Первые два фермента - ФРДФ-синтетаза и ФРДФ-амидофосфорибозилтрансфераза определяют скорость синтеза пуриновых нуклеотидов по основному пути, и их ингибирование происходит лишь при одновременном повышении концентрации АМФ и ГМФ. Активность аденилосукцинатсинтетазы и ИМФ-дегидрогеназы, находящихся на разветвлении метаболического пути, снижается при увеличении количества конечного продукта, образующегося в каждой из ветвей. АМФ ингибирует превращение ИМФ в аденилосукцинат, а ГМФ - превращение ИМФ в ксантозин-5'-монофосфат (КМФ). Превращение ИМФ в аденилосукцинат в ходе синтеза АМФ требует ГТФ, а превращение КМФ в ГМФ - АТФ. Перекрестная регуляция путей использования ИМФ служит для того, чтобы снизить синтез одного пуринового нуклеотида при дефиците другого и обеспечить сбалансированное содержание адениловых и гуаниловых нуклеотидов. 5. Запасные пути синтеза. Пуриновые нуклеотиды синтезируются «запасными» путями из азотистых оснований и нуклеозидов. Эти пути имеют вспомогательное значение, давая от 10 до 20% общего количества нуклеотидов. При этом используются азотистые основания и нуклеозиды, образующиеся в процессе катаболизма нуклеиновых кислот («путь спасения»). Эти реакции катализируют ферменты:
Мононуклеотиды под действием фосфатаз или нуклеотидаз теряют фосфатный остаток и превращаются в нуклеозиды. Аденозин дезаминируется, отщепляет рибозу и образует гипоксантин. Гуанозин в результате сходных реакций превращается в ксантин. Под действием ксантиноксидазы гипоксантин и ксантин окисляются в мочевую кислоту Последние стадии процесса катализирует фермент ксантиноксидаза, участвующая в превращении азотистых оснований в конечный продукт. Она окисляет гипоксантин в ксантин и ксантин в мочевую кислоту с участием молекулярного кислорода. Образование мочевой кислоты происходит главным образом в печени и кишечнике. У человека мочевая кислота является конечным продуктом обмена пуринов и выводится из организма с мочой и немного через кишечник. В норме содержание мочевой кислоты в сыворотке крови составляет 0,15-0,47 ммоль/л, или 3-7 мг/дл, а в суточной моче - 400-600 мг/дл. Частым нарушением катаболизма пуринов является гиперурикемия, которая возникает, когда в плазме крови концентрация мочевой кислоты превышает норму. На фоне гиперурикемии развивается подагра - заболевание, при котором мочевая кислота и ураты из-за плохой растворимости начинают кристаллизоваться и откладываться в суставных хрящах, связках и мягких тканях с образованием подагрических узлов или тофусов, вызывая воспаление суставов и почечнокаменную болезнь. Подагрой страдает от 0,3 до 1,7% населения земного шара. У мужчин сывороточный фонд уратов в 2 раза выше, чем у женщин, поэтому они болеют подагрой в 20 раз чаще, чем женщины. Заболевание генетически детерминировано и вызвано: • дефектами ФРДФ-синтетазы, связанными с гиперактивацией фермента, либо его устойчивостью к ингибированию конечными продуктами синтеза; • частичной потерей активности гипоксантин-гуанинфосфорибозилтрансферазы, которая обеспечивает повторное использование пуринов. При полной потере активности гипоксантин-гуанинфосфорибозилтрансферазы развивается тяжелая форма гиперурикемии - синдром Леша-Нихена, при котором наблюдаются неврологические и психические отклонения. В первые месяцы жизни детей неврологические расстройства еще не наблюдаются, но на пеленках обнаруживаются розовые и оранжевые пятна, вызванные повреждением мочевыводящих путей кристаллами мочевой кислоты. Болезнь наследуется как рецессивный признак, сцепленный с Х-хромосомой, и встречается только у мальчиков. Лечат подагру диетой, ограничивающей потребление мясных продуктов, и аллопуринолом - структурным аналогом гипоксантина. Ксантиноксидаза окисляет препарат в оксипуринол, который прочно связывается с активным центром фермента и останавливает катаболизм пуринов на стадии гипоксантина, который в 10 раз лучше растворим в жидкостях организма, чем мочевая кислота.
|
|||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 206; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.46.129 (0.007 с.) |

 2. Основным путем образования пуриновых нуклеотидов является синтез из простых предшественников (de novo).
2. Основным путем образования пуриновых нуклеотидов является синтез из простых предшественников (de novo).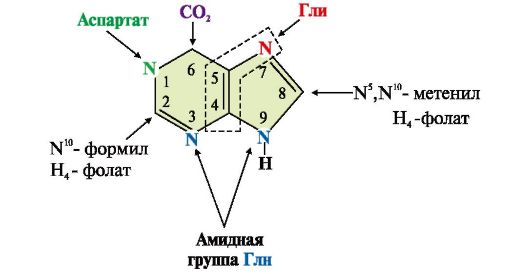 Рис. 10.1 Происхождение атомов С и N в пуриновом основании
Рис. 10.1 Происхождение атомов С и N в пуриновом основании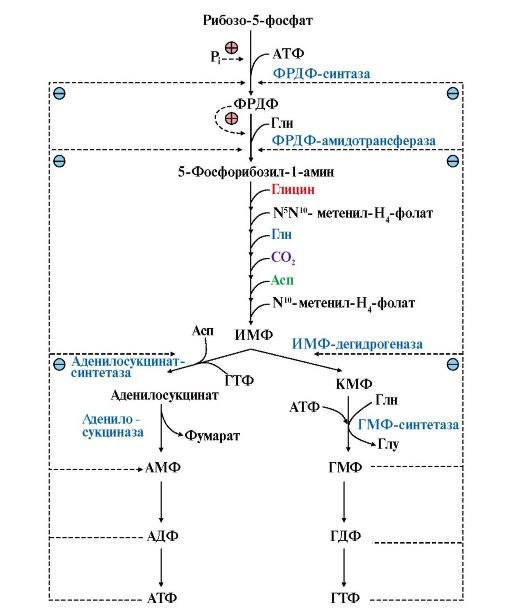 Рис. 10.2. Синтез пуриновых нуклеотидов и его регуляция.
Рис. 10.2. Синтез пуриновых нуклеотидов и его регуляция. Рис. 10.3. Синтез пуриннуклеозидди- и -трифосфатов
Рис. 10.3. Синтез пуриннуклеозидди- и -трифосфатов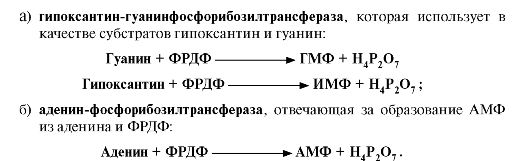 Еще один «запасной» путь включает фосфорилирование пуриновых нуклеозидов с помощью АТФ. Так, аденозинкиназа катализирует фосфорилирование аденозина до АМФ или дезоксиаденозина до дАМФ:
Еще один «запасной» путь включает фосфорилирование пуриновых нуклеозидов с помощью АТФ. Так, аденозинкиназа катализирует фосфорилирование аденозина до АМФ или дезоксиаденозина до дАМФ: 6. Катаболизм пуриновых нуклеотидов. Гиперурикемия, подагра. Мононуклеотиды теряют фосфатный остаток гидролитически под действием фосфатаз или нуклеотидаз с образованием нуклеозидов. Дальнейшие превращения в мочевую кислоту сопровождаются гидролитическим дезаминированием с участием аденозиндезаминазы или гуаназы и отщеплением рибозы, которое ускоряется пуриннуклеозидфосфорилазой (рис. 10.4).
6. Катаболизм пуриновых нуклеотидов. Гиперурикемия, подагра. Мононуклеотиды теряют фосфатный остаток гидролитически под действием фосфатаз или нуклеотидаз с образованием нуклеозидов. Дальнейшие превращения в мочевую кислоту сопровождаются гидролитическим дезаминированием с участием аденозиндезаминазы или гуаназы и отщеплением рибозы, которое ускоряется пуриннуклеозидфосфорилазой (рис. 10.4).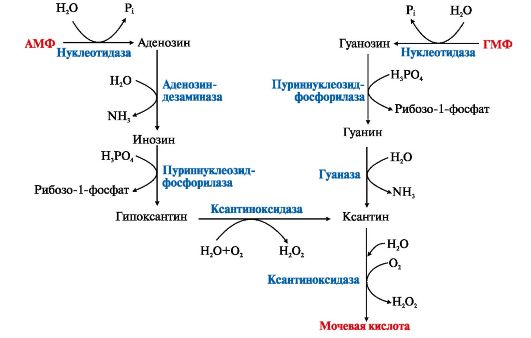 Рис. 10.4. Катаболизм пуриновых нуклеотидов. Образование мочевой кислоты.
Рис. 10.4. Катаболизм пуриновых нуклеотидов. Образование мочевой кислоты.


