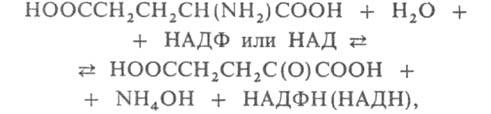Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительное дезаминирование аминокислот. Глутаматдегидрогеназа. Значение этой реакции.
3. Катаболизм аминокислот начинается с реакции дезаминирования - удаления α-аминогруппы, которая выделяется в виде аммиака и образования безазотистого остатка (α-кетокислоты). При дезаминировании в отличие от трансаминирования общее количество аминокислот уменьшается. Продукт дезаминирования аммиак - токсичное соединение, в клетках подвергается обезвреживанию. Безазотистый остаток представляет собой α-кетокислоту, которая включается: • в реакции окисления до СО2 и Н2О; • в реакции трансаминирования для синтеза заменимых аминокислот; • в анаплеротические реакции для восполнения убыли метаболитов ОПК или для синтеза других соединений; • в глюконеогенез; • в кетогенез. Дезаминированию подвергаются все аминокислоты кроме лизина и пролина (табл. 9.3). Существует несколько типов реакций дезаминирования: • окислительное - характерно только для Глу; • неокислительное - характерно для Сер, Тре и Гис; • непрямое - для остальных аминокислот. Прямому окислительному дезаминированию подвергается только глутамат. Окислительное дезаминирование глутамата происходит под действием фермента глутаматдегидрогеназы, коферментом которого является NAD+. Реакция идет в митохондриях многих тканей, наиболее активно - в печени. В реакцию неокислительного дезаминирования вступают: • серин и треонин - с отщеплением воды; • гистидин - внутримолекулярным способом. Большинство аминокислот подвергается в клетке непрямому дезаминированию, которое включает две стадии: А. Трансаминирование с α-кетоглутаратом и образование Глу в цитозоле клетки; Б. Окислительное дезаминирование Глу в митохондриях. Центральную роль в непрямом дезаминировании играют глутамат и α-кетоглутарат. Другой тип дезаминирования аминокислот - непрямое неокислительное - происходит с участием цикла ИМФ-АМФ и характерен для мышечной ткани и мозга, в которых глутаматдегидрогеназа малоактивна:
Таблица 9.3. Реакции дезаминирования аминокислот
• голодании в результате ускорения распада белков тканей; • поступлении с пищей больших количеств белка; • сахарном диабете и других длительно протекающих тяжелых заболеваниях, также сопровождающихся распадом тканевых белков. ГЛУТАМАТДЕГИДРОГЕНАЗА фермент, катализирующий взаимопревращение L-глутаминовой и2-оксоглутаровой к-т: где НАДФ (НАД) и НАДФН (НАДН) соотв. окисленная и восстановленная форма коферментаникотинамидаденин-динуклеотидфосфата (никотинамидадениндинуклеотида) - акцепторы и переносчикиэлектронов и водорода на промежут. стадиях. Относится к классу оксидоредуктаз. Различают Г. специфичные к НАД, НАД и НАДФ или только к НАДФ. Фермент имеет мол. м. 210-480 тыс. иобычно состоит из 4 или 6 одинаковых субъединиц. В активном центре содержатся остатки лизина, тирозинаи ци-стеина. Третичная структура характеризуется наличием доменов с мол. м. 20 тыс. Известна первичнаяструктура нескольких Г. Оптим. каталитич. активность при аминировании в области рН 7,5-8,5, придезаминировании 8,5-9,5. Г. содержится в животных, растениях и микроорганизмах. В бактериях и синезеленых водоросляхпредставлена одной формой, в др. организмах - неск. изоферментами. Долгое время Г. рассматривали какосн. фермент первичной ассимиляции NH3. Низкое сродство Г. к NH4+, а также открытие глутаматсинтазы, обнаруженной во всех, кроме животных, организмах, свидетельствуют, что роль Г. в ассимиляции NH3незначительна.
|
||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 142; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.66.13 (0.005 с.) |
 Аминогруппа аминокислот с помощью двух последовательных реакций трансаминирования переносится на ИМФ с образованием АМФ, который гидролитически дезаминируется с выделением аммиака.
Аминогруппа аминокислот с помощью двух последовательных реакций трансаминирования переносится на ИМФ с образованием АМФ, который гидролитически дезаминируется с выделением аммиака.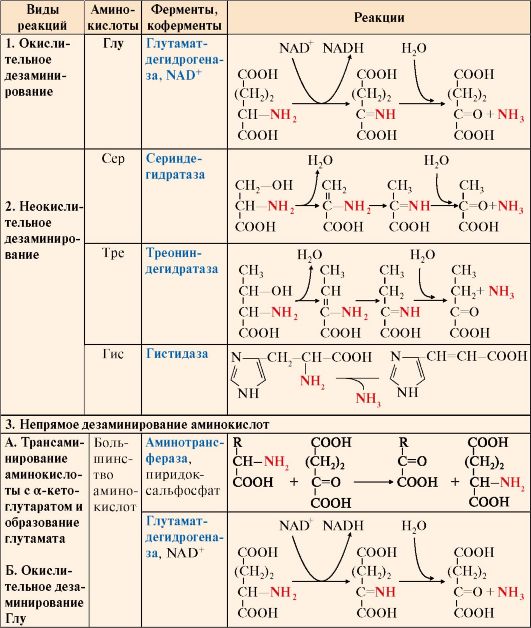 Катаболизм аминокислот и, соответственно, реакции дезаминирования ускоряются при:
Катаболизм аминокислот и, соответственно, реакции дезаминирования ускоряются при: