
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Непрямое дезаминирование аминокислот: последовательность реакций, ферменты, биологическое значение.Содержание книги
Поиск на нашем сайте
Непрямое дезаминирование происходит в два этапа: 1. Трансаминирование – аминокислота передает аминогруппу a-КГ и при этом превращается в кетоформу, а a-КГ – в глутаминовую:
2. Окислительное дезаминирование ГЛУ с выделением аммиака.
a-КГ может вновь вступать в реакции трансаминирования с другой аминокислотой, затем дезаминироваться. Поскольку обе реакции (трансаминирование и дезаминирование глутаминовой кислоты) являются обратимыми, создаются условия для синтеза любой заменимой аминокислоты, если в организме имеются соответствующие a-кетокислоты. Организм человека и животных не наделен способностью синтеза незаменимых аминокислот, из-за отсутствия соответствующих a-кетокислот. После дезаминирования углеродный скелет аминокислоты либо окисляется в аэробных условиях и служит источником энергии, либо используется в биосинтезе соединений.
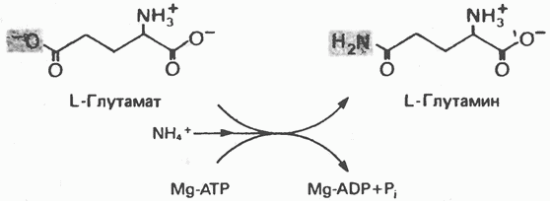
Пути биосинтеза заменимых аминокислот из глюкозы. БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ Из 12 заменимых аминокислот (табл. 29.1) 9 образуются из амфиболических метаболитов, а три Центральное место в биосинтезе аминокислот занимают глутаматдегидрогеназа, глутаминсинтаза и трансаминазы. Благодаря совместному действию этих ферментов катализируется включение неорганического иона аммония в а-аминогруппу аминокислот. Глутамат Восстановительное аминирование а-кетоглутарата катализируется глутаматдегидрогеназой (рис. 29.1). Помимо того что эта реакция приводит к образованию L-глутамата из амфиболического метаболита, а-кетоглутарата, она является ключевой стадией биосинтеза многих других аминокислот. Глутамин Биосинтез глутамина из глутамата катализируется глутаминсинтетазой (рис. 29.2). Данная реакция имеет как сходство с реакцией, катализируемой
Рис. 29.1. Реакция, катализируемая глутаматдегидрогеназой. Восстановительное аминирование а-кетоглутарата ионами NH происходит за счет
Рис. 29.2. Реакция, катализируемая глутаминсинтетазой.
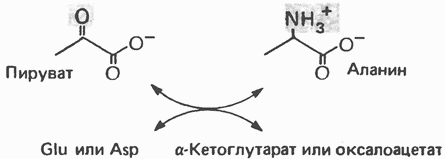
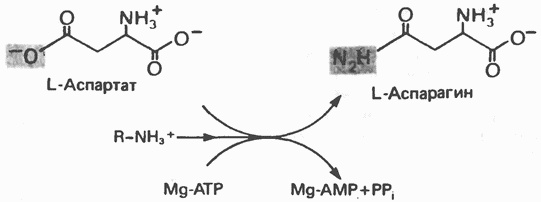
Рис. 29.3. Образование аланина путем переаминировання пирувата. Донором аминогруппы может быть глутамат или аспартат. Другим продуктом реакции служит а-кетоглутарат или оксалоацетат. глутаматдегидрогеназой, так и отличия от нее. В обоих случаях «фиксируется» неорганический азот, который в одном Случае включается в аминогруппу, а в другом — в амидную группу. Обе реакции сопряжены с сильно экзергоническими реакциями: в случае глутаматдегидрогеназы с окислением Аланин и аспартат L-аланин образуется из пирувата путем переами-нирования с глутаматом, а Аспарагин Образование аспарагина из аспартата, катализируемое аспарагинсинтетазой (рис. 29.4), сходно с синтезом глутамина (рис. 29.2). Аспарагинсинтетаза млекопитающих в качестве источника азота использует не ион аммония, а глутамин и, следовательно, не «фиксирует» неорганического азота. Бактериальные же аспарагинсинтетазы используют ион аммония, следовательно, «фиксируют» неорганический азот. Как и в случае других реакций, сопровождающихся образованием Серин Серин образуется из гликолитического промежуточного продукта D-3-фосфоглицерата (рис. 29.5). а-гидроксильная группа при участии NAD+ окисляется в оксогруппу; далее в результате переаминирования образуется фосфосерин, который затем дефосфорилируется, образуя серин. Глицин Синтез глицина в тканях млекопитающих осуществляется несколькими путями. В цитозоле печени содержится глицинтрансаминаза, катализирующая синтез глицина из глиоксилата и глутамата (или аланина). В отличие от большинства реакций переаминирования равновесие этой реакций сильно смещено в направлении синтеза глицина. Два важных дополнительных пути, функционирующие у млекопитающих, используют для образования глицина холин (рис. 29.6) и серин; в последнем случае катализ осуществляется серингидроксиметилтрансферазой (рис. 29.7). Пролин У млекопитающих и некоторых других организмов пролин образуется из глутамата путем обращения реакций катаболизма пролина (рис. 29.8). Гидроксипролин Поскольку пролин служит предшественником гидроксипролина, то обе аминокислоты рассматривают как принадлежащие к глутаматному семейству аминокислот. Хотя в тканях млекопитающих встречаются как 3-, так и 4-гидроксипролин, в последующем изложении - речь будет идти исключительно о
Рис. 29.4. Реакция, катализируемая аспарагинсинтетазой. Обратите внимание на сходство и различия с реакцией, катализируемой глутаминсинтетазой (рис. 29.2). Природа донора аминогруппы
Рис. 29.5. Биосинтез серина. а-АК—а-аминокислота, а-КК—а-кетокислота. Гидроксипролин, как и гидроксилизин, содержится в тканях практически только в составе коллагена, на долю которого приходится большая часть белка в организме млекопитающих. В коллагене одна треть аминокислотных остатков приходится на глицин и еще одна треть на пролин и гидроксипролин. Гидроксипролин, представленный в коллагене весьма большим числом остатков, стабилизирует тройную спираль коллагена по отношению к действию протеаз. В отличие от гидроксилизина, гидроксильная группа которого служит местом присоединения остатков галактозы и глюкозы, гидроксильные группы гидроксипролина в коллагене остаются незамещенными. Уникальной особенностью метаболизма гидроксипролина и гидроксилизина является то обстоятельство, что этиаминокислоты, входящие в состав
Рис. 29.6. Образование глицина из холина.
Рис. 29.7. Реакция, катализируемая серингидрокси-метилтрансферазой. Реакция легко обратима. белков пищи, не включаются в коллаген. Не существует
Рис. 29.8. Биосинтез пролина из глутамата путем обращения реакций катаболизма пролина. Гидроксилирование пролина (или лизина) катализируется пролилгидроксилазой (или лизилгидроксилазой) - ферментами, находящимися в микросомальной фракции многих тканей (кожи, печени, легких, сердца, скелетной мышцы, гранулирующих раневых поверхностей). Эти ферменты являются пептидилгид-роксилазами, поскольку гидроксилирование происходит только после включения пролина или лизина в полипептидную цепь (см. гл. 55). Обе гидроксилазы являются оксигеназами со смешанной функцией и функционируют при участии молекулярного кислорода, аскорбата, ионов
Рис. 29.9. Реакция, катализируемая пролилгидроксилазой. Субстратом служит богатый пролином пептид. В результате реакции один атом молекулярного кислорода поступает в сукцинат, а другой — в пролин (установлено с использованием Цистеин Цистеин, не относящийся к незаменимым аминокислотам, образуется из незаменимого метионина и заменимого серина. Сначала происходит превращение метионина в гомоцистеин с образованием на промежуточных стадиях Тирозин Тирозин образуется из фенилаланина в реакции, катализируемой фенилаланингидроксилазой (рис. 29.11), поэтому фенилаланин относится к незаменимым аминокислотам, а тирозиннет (при условии, что диета содержит достаточное количество фенилаланина). Реакция необратима, и поэтому тирозин не может заменить пищевой фенилаланин. Фенилала-нингидрокснлазный комплекс является оксигеназой со смешанной функцией, она имеется в печени млекопитающих и отсутствует в других тканях. В результате
Рис. 29.10. Превращение гомоцистеина и серина в гомосе-рин и цистеин. Атом серы поступает в цистеин от метионина, углеродный скелет — от серина. реакции один атом молекулярного кислорода включается в пара-положение фенилаланина, а другой восстанавливается, образуя воду (рис. 29.11). Восстановительные эквиваленты, первоначально поставляемые NADPH, затем передаются непосредственно участвующему в реакции тетрагидробиоптерину—птеридину, подобному по структуре фрагменту фолиевой кислоты. Гидроксилизин 5-Гидроксилизин (а, е-диамино-8-гидроксикапроат) входит в состав коллагена и отсутствует в большинстве других белков млекопитающих. Г идроксилизин в составе коллагена происходит из пищевого лизина, но не пищевого гидроксилизина. Перед гидроксилированием лизин должен включиться в пептидную цепь. Гидроксилирование остатка лизина в составе пептида катализируется лизилгидроксила-зой—оксигеназой со смешанной функцией, аналогичной пролилгидроксилазе (рис. 29.9).
Рис. 29.11. Реакция, катализируемая фенилаланин-гидроксил азой. Она осуществляется с участием двух типов активности. Активность II катализирует восстановление дигидробиоптерина за счет NADPH, активность I— восстановление
|
||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 202; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.009 с.) |



 незаменимых аминокислот.
незаменимых аминокислот.

 а в случае глутаминсинтетазы с гидролизом АТР.
а в случае глутаминсинтетазы с гидролизом АТР. -аспартаттем же путем из оксалоацетата (рис. 29.3). Перенос а-аминогруппы глутамата на амфиболические метаболиты иллюстрирует участие трансаминаз в процессах включения иона аммония в а-аминогруппы аминокислот.
-аспартаттем же путем из оксалоацетата (рис. 29.3). Перенос а-аминогруппы глутамата на амфиболические метаболиты иллюстрирует участие трансаминаз в процессах включения иона аммония в а-аминогруппы аминокислот. последующий гидролиз РР, до Р, с участием пирофосфатазы обеспечивает энергетически благоприятные условия для протекания реакции.
последующий гидролиз РР, до Р, с участием пирофосфатазы обеспечивает энергетически благоприятные условия для протекания реакции.
 может различаться у разных организмов.
может различаться у разных организмов.


 фолат— тетрагидрофолат.
фолат— тетрагидрофолат. которая могла бы акцептировать гидроксипролин или гидроксилизин и далее включать их в растущую полипептидную цепь. В то же время пищевой пролин является предшественником гидроксипролина, а пищевой лизин—предшественником гидроксилизина в составе коллагена.
которая могла бы акцептировать гидроксипролин или гидроксилизин и далее включать их в растущую полипептидную цепь. В то же время пищевой пролин является предшественником гидроксипролина, а пищевой лизин—предшественником гидроксилизина в составе коллагена.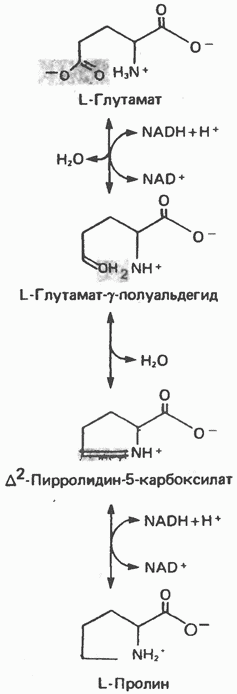
 и а-кетоглутарата. Пролилгидроксилаза изучена более подробно; есть основания полагать, что лизилгидроксилаза действует аналогичным образом. На каждый мольгидроксилированного пролина декарбоксилируется I моль а-кетоглутарата с образованием сукцината. В ходе этого процесса один атом кислорода молекулы
и а-кетоглутарата. Пролилгидроксилаза изучена более подробно; есть основания полагать, что лизилгидроксилаза действует аналогичным образом. На каждый мольгидроксилированного пролина декарбоксилируется I моль а-кетоглутарата с образованием сукцината. В ходе этого процесса один атом кислорода молекулы  включается в состав пролина, а другой — в сукцинат (рис. 29.9).
включается в состав пролина, а другой — в сукцинат (рис. 29.9).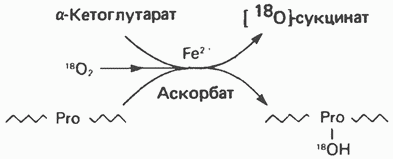
 ).
). -аденозилметионина и
-аденозилметионина и  -аденозилгомоцистеина (см. гл. 31). Превращение гомоцистеина и серина в цистеин и гомосерин показано на рис. 29.10.
-аденозилгомоцистеина (см. гл. 31). Превращение гомоцистеина и серина в цистеин и гомосерин показано на рис. 29.10.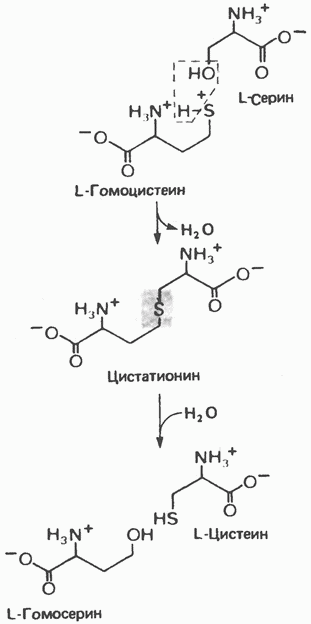

 в
в  и превращение фенилаланина в тирозин. Нарушения хода этой реакции лежат в основе нарушений метаболизма фенилаланина, которые обсуждаются в гл. 31.
и превращение фенилаланина в тирозин. Нарушения хода этой реакции лежат в основе нарушений метаболизма фенилаланина, которые обсуждаются в гл. 31.


