Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Индексы, характеризующие работу сердцаСодержание книги
Поиск на нашем сайте
Сердечный индекс (СИ) представляет собой отношение МВ к площади поверхности тела (5). Он составляет 3—4 л/мин/м2. Показатель введен из-за вариабельности МВ у разных лиц и является одним из вариантов выражения МВ: СИ = ^^[л/м2/мин]. Индекс кровоснабжения (ИК) отражает отношение МВ в миллиметрах к массе тела (МТ) в килограммах: ИК = [мл/кг/мин]. В норме индекс составляет около 70 мл/кг/мин. Индекс выброса (менее точное название — фракция выброса) — отношение СВ к конечно-диастолическому объему. В норме в состоянии покоя индекс выброса составляет около 0,5. Ультразвуковое исследование (УЗИ) сердца впервые было применено в 1950 г. Для исследования внутренних органов используется ультразвук частотой 2— 3 мГц; он проходит через ткани с огромной скоростью — 1540 м/с, благодаря чему не повреждает их. Часть ультразвуковых волн отражается от тканей (на границе двух сред с различной плотностью) и фиксируется на экране осциллографа в виде свечения различной яркости. Это позволяет оценивать состояние клапанного аппарата сердца (вальвулография), регистрировать сократительную способность сердечной мышцы, геометрические параметры сердца, его полостей, отдельных участков сердечной стенки, рассчитать индекс выброса. Ангиокардиография — рентгенологический метод исследования полостей сердца и магистральных сосудов при введении в кровь рентгеноконтрастных веществ; позволяет судить о сократительной функции сердца, об объеме полостей сердца, просвете сосудов, толщине стенок сердца, о наличии пороков сердца. 11.6. Регуляция деятельности сердца Сердце очень быстро реагирует на эмоциональное и физическое напряжение,
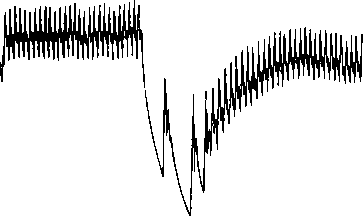
Рис. 11.11. Торможение деятельности сердца и падение АД при раздражении блуждающего нерва у кролика
связанное с изменениями внешней и внутренней среды организма, с трудовой деятельностью, занятиями спортом (реакции других внутренних органов не являются такими быстрыми). Механизмы регуляции деятельности сердца, как и любого мышечного органа, — нервный, гуморальный и миогенный. Регуляция с помощью блуждающих нервов. Эти нервы оказывает тормозное влияние на сердце (рис. 11.11). Волокна от правого блуждающего нерва иннервируют преимущественно правое предсердие, и особенно обильно — синоатриальный узел. К атриовентрикулярному узлу подходят главным образом волокна от левого блуждающего нерва. Парасимпатическая иннервация желудочков выражена слабее, чем предсердий. Преганглионарные парасимпатические волокна (аксоны нейронов ядер блуждающих нервов, расположенных в каудальном отделе продолговатого мозга) образуют синаптические контакты с собственными внутрисердечными эффекторными холинергическими нейронами в сердце и посредством их реализуют свое влияние. Блуждающий нерв регулирует деятельность синоатриального и атриовентрикулярного узлов при каждом сокращении сердца с помощью активации ионотропных К-каналов.
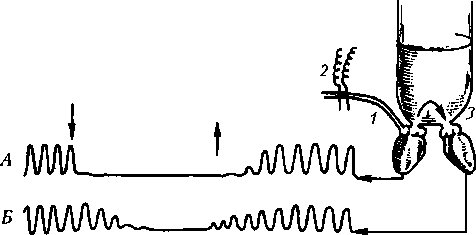
z-l Z А Б Б Рис.11.12. Схема опыта на сердце, иллюстрирующего наличие тонуса блуждающих нервов и отсутствие тонуса симпатических нервов (регистрация ЭКГ): А — нарастание ЧСС у голубя после двусторонней ваготомии (стрелка)', Б — фоновая ЧСС у морской свинки; В — ЧСС этой же морской свинки в условиях блокады симпатической нервной системы орнидом (без изменений). Отметка времени 1 с Раздражение периферического отрезка блуждающего нерва вызывает торможение деятельности сердца (братья Веберы, 1845; см. рис. 11.11). Тонус блуждающих нервов выражен ярко, о чем свидетельствует тот факт, что перерезка их в эксперименте или блокада атропином вызывают значительное повышение ЧСС (рис. 11.12). Поскольку блуждающий нерв все время сдерживает деятельность сердца, уменьшение его тонуса ведет к учащению, а увеличение — к урежению сердечных сокращений, т.е. один и тот же нерв при наличии собственного тонуса обеспечивает двоякий эффект и более совершенную регуляцию. Тонус блуждающего нерва изменяется в ритме дыхания, в результате чего ЧСС и АД возрастают во время вдоха (вследствие уменьшения импульсации в блуждающих нервах) и уменьшаются во время выдоха (дыхательная аритмия), что связано с увеличением импульсации в блуждающем нерве во время выдоха. Активность симпатического нерва изменяется в противофазе — больше на вдохе, меньше на выдохе. Однако на дыхательную аритмию она не влияет, так как тонус симпатического нерва для сердца не выражен. Усиление импульсации в симпатических нервных волокнах на вдохе ведет к активации а-адреноре- цепторов, сужению сосудов, что способствует повышению АД на вдохе.
Тонус любого центра поддерживается афферентными импульсами, гуморальными влияниями, спонтанной активностью самих нейронов (это свойство особо выражено в нейронах РФ). Медиаторный механизм передачи влияний с вегетативных нервов на орган открыл О. Леви (1921). В опыте на двух изолированных сердцах лягушки он раздражал вагосимпатический ствол, иннервирующий одно сердце, и наблюдал торможение с последующим усилением и ускорением сердечной деятельности. Перфузирующий раствор от этого сердца попадал в другое сердце, деятельность которого изменялась так же, как и первого сердца (рис. 11.13). Медиатором парасимпатической нервной системы является ацетилхолин. В сердце он посредством М2-ионотроп- ных рецепторов непосредственно активирует калиевые каналы пейсмекерных клеток, но снижает активность Na- и Са-каналов с помощью вторых посредников, а именно вследствие угнетения активности системы аденилатцикла- за — цАМФ, и поэтому МДД замедляется, задерживается и проведение возбуждения в атриовентрикулярном узле, ЧСС урежается. Норадреналин действует в противоположном направлении. Взаимодействие ацетилхолина с М2-метаботропными рецепторами рабочего миокарда (G-белок и образование цГМФ) ведет к активации быстрых управляемых К-каналов (увеличивается проницаемость для К+), но к уменьшению проницаемости мембраны для Са2+ и Na+ вследствие угнетения системы аденилатциклаза — цАМФ. Уменьшение входа Са2+ в клетки рабочего миокарда ведет к ослаблению силы сокращений сердца. Влияние блуждающего нерва на рабочий миокард предсердий выражено значительно больше, нежели на таковой желудочков. Выделяемый парасимпатическими окончаниями ацетилхолин ограничивает также адренергические влияния и в предсердиях, и в желудочках за счет подавления освобождения норадреналина из симпатических терминалей и существенного ограничения ответа на норадреналин на уровне Р-адренорецепторов за счет угнетения аденилатциклазного пути, активируемого норадреналином. Ацетилхолин угнетает также АТФазную активность миозина, что тоже ведет к ослаблению сокращений предсердий. Феномен ускользания из- под влияния блуждающего нерва (escape). При сильном раздражении и возбуждении блуждающего нерва гиперполяризация пейсмекерных клеток может быть столь выраженной, что возбуждение их становится невозможным, и сердце останавливается. Однако при продолжающемся раздражении сокращения сердца возобновляются. Роль симпатических нервов в регуляции деятельности сердца. В каудальном отделе продолговатого мозга имеется центр, нейроны которого свои аксоны посылают к симпатическим нейронам спинного мозга, регулирующим деятельность сердца. Преганглионарные симпатические сердечные волокна берут начало в боковых рогах пяти верхних грудных сегментов спинного мозга (Tht—Th5) и прерываются в верхнем, среднем и, в основном, нижнем шейном ганглиях. Последний обычно объединяется с верхним грудным — вместе они образуют звездчатый ганглий. Синоатриальный узел иннервируется преимущественно правым симпатическим нервом, атриовентрикулярный узел — преимущественно левым симпатическим нервом. Симпатические нервы, в отличие от парасимпатических, практически равномерно распределены по всем отделам сердца и регулируют их деятельность.
Раздражение симпатического нерва вызывает увеличение частоты
В ’■•■■■I Рис. 11.14. Учащение и усиление сердечной деятельности у собаки при раздражении сердечной веточки звездчатого ганглия электрическим током в остром эксперименте: А — кровяное давление в сонной артерии; Б — давление в левом желудочке сердца; В — скорость нарастания давления в желудочке (первая производная давления, ДР/ At) (Цион, 1867) и силы (Павлов И. П., 1887) сердечных сокращений (рис. 11.14). Медиатором симпатического нерва является норадреналин. Действие катехоламинов на сердце реализуется с помощью вторых посредников (адренорецепторы метаботропные) и активации электрофизиологических и биохимических процессов. В частности, увеличивается проницаемость мембран пейсмекерных клеток для Na+ и Са2+, поступление которых по медленным каналам в клетки ускоряет их МДД — электрофизиологический процесс, наблюдается хронотропный эффект. Возрастание тока Са2+ в клетки рабочего миокарда ведет также к усилению сокращений сердца. При этом Са2+ больше накапливается и в СПР, а значит, больше высвобождается при очередном возбуждении кардиомиоцитов. Эти эффекты реализуются посредством ^-адренорецепторов и активации внутриклеточного фермента аденилат- циклазы, которая ускоряет образование цАМФ; последний активирует фосфорилазу. При этом ускоряется также расщепление гликогена (биохимический процесс). Освобождение энергии обеспечивает усиление сокращений всех кардиомиоцитов — и предсердий, и желудочков. Симпатические нервы ускоряют проведение возбуждения в области атриовентрикулярного узла. Возрастание скорости проведения возбуждения увеличивает синхронизацию деполяризации и сокращения кардиомиоцитов, что также усиливает сердечные сокращения. p-Адренорецепторы более плотно расположены в желудочках сердца. Они локализуются на сократительных элементах сердечной ткани и на проводящей системе сердца. Имеются 0j- и р2-подтипы, но преобладают ^-рецепторы — их около 80 %. Активация обоих типов Р-рецепторов сопровождается ино- и хронотропным эффектами (см. ниже, п. 11.6). У Р2-рецепторов более выражено хронотропное влияние, чему способствует достаточное насыщение ими проводящей системы сердца. Однако основная функция Р2-рецепторов сердца — регуляция метаболизма; эти рецепторы находятся преимущественно на фибробластоподобных клетках.
Роль Р2-рецепторов возрастает при сердечной недостаточности, что может быть обусловлено десенситизацией Pj-рецепторов, в то время как активность Р2-рецепторов изменяется мало. Роль а-адренорецепторов в регуляции деятельности сердца дискутируется. В экспериментах в условиях целого организма даже очень сильное раздражение симпатического нерва (10—30 В) в течение 30—60 с в условиях блокады Р-адренорецепторов пропранололом ино- и хронотропного феноменов не вызывает (В.М. Смирнов). Это свидетельствует о том, что симпатический нерв оказывает свое быстрое влияние на сердце только с помощью [3-адренорецепторов. Тонус симпатического нерва для сердца не выражен: это показано в опытах, выполненных на многих видах животных. После блокады симпатических нервов деятельность сердца не изменяется (см. рис. 11.12, Б и В). Поскольку тонус симпатического нерва для сердца не выражен, он может только стимулировать сердечную деятельность. Эфферентные влияния симпатического и парасимпатического нервов выражаются не только в изменении ЧСС (хронотропное влияние} и их силы (инотропное влияние), но также в изменении проводимости (дромотроп- ное влияние) и возбудимости миокарда (батмотропное влияние). Все влияния на сердце блуждающего нерва являются отрицательными, а симпатического нерва — положительными. Инотропное влияние парасимпатического нерва на предсердия выражено лучше, чем на желудочки. В спокойном состоянии организма ЧСС определяется тонусом блуждающего нерва и гуморальными веществами, циркулирующими в крови, а при эмоциональной и физической нагрузках ЧСС возрастает в результате уменьшения тонуса блуждающего нерва и возбуждения симпатической нервной системы. Афферентная импульсация от механорецепторов сердца и сосудистых рефлексогенных зон (главные — аортальная и синокаротидная), идущая в ЦНС по чувствительным волокнам блуждающих и симпатических нервов, в соответствии с принципом отрицательной обратной связи обеспечивает торможение деятельности сердца при высоком АД и усиление сердечных сокращений при уменьшении АД. Эти эффекты реализуются с помощью эфферентных влияний блуждающего и симпатического нервов. Причем влияние симпатических нервов на сердце включается только при падении АД, поскольку тонус их для сердца не выражен. Важную роль в регуляции деятельности сердца играют рефлексы, возникающие с хеморецепторов синокаротидной и аортальной рефлексогенных зон, а также других сосудов: в условиях гипоксии развивается рефлекторная тахикардия, а при дыхании чистым кислородом — брадикардия, что необходимо учитывать в клинической практике. С волюморецепторов полых вен и правого предсердия при резком их растяжении возникает рефлекторная тахикардия (рефлекс Бейнбриджа) вследствие возбуждения симпатической нервной системы. Этот рефлекс обеспечивает разгрузку правого желудочка от повышенного притока крови к нему.
Миогенный механизм регуляции силы сокращений сердца включает гетеро- и гомеометрический механизмы. Гетерометрический миогенный механизм регуляции деятельности сердца заключается в том, что предварительное растяжение полоски сердечной мышцы увеличивает силу ее сокращения (Франк О., 1895). На сердечно-легочном препарате подобные исследования провел Э. Старлинг (1918). Однако растяжение должно быть умеренным, обеспечивающим максимальное число зон зацепления с помощью миозиновых мостиков нитей миозина и актина. Увеличению силы сокращений сердца при увеличении растяжения его стенок способствует и дополнительный выход Са2+ из СПР, а также эластические растянутые элементы. Кальций увеличивает число миозиновых мостиков, взаимодействующих с нитями актина. Растяжение любой мышцы ведет к усилению сокращения также благодаря увеличению поверхности контакта митохондрий с миофибриллами и ускорению поступления АТФ в миоциты. Значение механизма Франка—Старлинга заключается в усилении сердечной деятельности в случае увеличения притока крови к сердцу (преднагрузкй). Гетерометрический механизм регуляции весьма чувствителен — проявляется уже при введении в магистральные вены всего 1—2 % ОЦК (рефлекторные механизмы срабатывают при увеличении объема крови на 5—10 %). Гомеометрический миоген- ный механизм регуляции деятельности сердца выражается в увеличении силы сокращений миокарда без предварительного его растяжения. Если постепенно увеличивать частоту раздражений полоски миокарда, то одновременно с увеличением частоты ее сокращений возрастает и сила (ритмоинотропная зависимость). Это объясняется увеличением запаса Са2+ в СПР кардиомиоцитов, в результате чего больше ионов Са2+ выделяется в ответ на каждый следующий ПД. Ионы Са2+, как известно, обеспечивают взаимодействие нитей актина и миозина при возбуждении мышечного волокна, что и ведет к усилению сокращений миокарда. При учащении сокращений сердца больше Са2+ поступает в клетку, и Са-помпа клеточной мембраны не успевает выкачивать его. Как нам представляется, это свидетельствует о том, что Са-помпа СПР работает эффективнее, чем Са-помпа мембран самих миоцитов. Роль внутрисердечной нервной системы. При высоком давлении в аорте наблюдается угнетения сердечной деятельности, при низком — ее усиление, т.е. внутрисердечная нервная система стабилизирует давление в артериальной системе, предупреждая резкие колебания давления в аорте (Г. И. Косицкий). Внутрисердечная нервная система образует периферические рефлекторные дуги, включающие афферентный нейрон (клетка Догеля II типа), дендрит которого оканчивается рецептором растяжения на кардиомиоцитах и коронарных сосудах, и эфферентный нейрон (клетка Догеля I типа), аксон которого заканчивается на кардиомиоцитах. Внутрисердечная рефлекторная дуга может иметь вставочный нейрон. Нейроны внутрисердечной нервной системы расположены поодиночке или собраны в ганглии. Основная масса их находится в непосредственной близости от синоатриального и атриовентрикулярного узлов. Роль гуморальных веществ в регуляции деятельности сердца. Гормональные влияния. Тироксин увеличивает частоту и силу сердечных сокращений, чувствительность сердца к симпатическим воздействиям, увеличивает синтез белков в сердце, что ведет к его гипертрофии. Кортикоиды, ангиотензин, серотонин, адреналин, норадреналин, вазопрессин, эндотелии (пептид эндоте- лиоцитов), глюкагон, инсулин увеличивают силу сокращений сердца. Механизм действия разных гормонов на сердце различен. Однако многие из них свое воздействие реализуют посредством активации аденилатциклазы, которая находится на внутренней стороне клеточной мембраны. Аденилатциклаза ускоряет образование цАМФ из молекул АТФ. Под действием цАМФ происходит ряд биохимических превращений, увеличивается поступление Са2+ в клетки, захват его и освобождение СПР. Адреналин и норадреналин, циркулирующие в крови, также увеличивают вход Са2+ в клетку в момент развития ПД, вызывая тем самым усиление сердечных сокращений, но их роль невелика. Действие кальция на сократимость с е р д ц а. Са2+усиливает сердечные сокращения, потому что он улучшает электромеханическое сопряжение, активирует фосфорилазу, что способствует высвобождению энергии. Большие концентрации Са2+ вызывают настолько сильное сокращение сердца в эксперименте, что оно останавливается в систоле. Влияние калия на сердечную деятельность зависит от его концентрации в крови. При снижении концентрации К+ вне клетки ниже нормы (4 ммоль/л) уменьшается его содержание и внутри клетки, вследствие чего уменьшается мембранный потенциал (частичная деполяризация). Это приводит главным образом к повышению активности пейсмекера, поскольку мембранный потенциал приближается к КП, при этом активизируются также гетеротопные очаги возбуждения, что может сопровождаться нарушениями сердечного ритма. Примерно такие же изменения в деятельности сердца наблюдаются и при небольшом увеличении (в 1,5-2 раза) концентрации К+ в окружающей среде. Увеличение же концентрации К+ вне клеток в 3—4 раза и более ведет к снижению возбудимости и проводимости кардиомиоцитов и даже к полной деполяризации клеток и остановке сердца, что используется в хирургической практике при операциях на сердце. Считается, что увеличение концентрации К+ вне клеток в 1,5—2 раза ведет к снижению его градиента к уменьшению выхода К+ из клеток и к частичной деполяризации клеток, что приводит к повышению возбудимости кардиомиоцитов. При увеличении же концентрации К+ в 3—4 раза и более наблюдается полная деполяризация кардиомиоцитов вследствие уменьшения градиента К+ или полного его отсутствия. Следует, однако, заметить, что добавляется электронейтральная среда (раствор соли КС1, чистый калий — это хрупкий металл и сгорает при контакте с водой). Гипоксия и гиперкапния посредством активации центральных и периферических хеморецепторов возбуждают симпатическую нервную систему, что ведет к стимуляции деятельности сердца. Легкая степень гипоксии, действуя непосредственно на сердце, стимулирует его работу, значительная — угнетает, что обусловлено ограничением окислительных процессов. Решающим фактором, сопутствующим гипоксии и гиперкапнии и действующим непосредственно на сердце, является изменение pH внутри клеток сердца. Снижение pH в кардиомиоцитах (в норме pH 7,1) ослабляет силу сокращений сердца вследствие угнетения освобождения Са2+ из СПР и снижения чувствительности миофиламентов к Са2+. Повышение температуры увеличивает, а понижение — снижает ЧСС. Корковые влияния на деятельность сердца реализуются посредством ВНС и эндокринных желез. Кора большого мозга обеспечивает возникновение более тонких приспособительных реакций сердца по механизму условного рефлекса и при эмоциях. Например, в предстартовом состоянии у спортсмена частота и сила сердечных сокращений увеличиваются еще до сигнала стартера, т.е. заблаговременно. Раздражение почти любого отдела коры большого мозга, особенно моторной и премоторной зон, поясной извилины, лобной, височной коры изменяет работу сердца. Эмоциональное напряжение сопровождается учащением сердцебиений. Положительные эмоции оказывают благоприятное влияние на сердце. Например, приятные воспоминания могут устранить экстрасистолию. Отрицательная эмоция, напротив, может сопровождаться спазмом коронарных сосудов и болевыми ощущениями. Легко вырабатываются условные рефлексы на изменение частоты и силы сердечных сокращений. Таким образом, корковые влияния обеспечивают более тонкое приспособление деятельности сердца к потребностям организма. 11.7. Основные показатели и закономерности гемодинамики В настоящее время термин «гемодинамика» применяют в двух значениях: 1) гемодинамика — учение о движении крови в сердечно-сосудистой системе; 2) гемодинамика — движение крови по сосудам (хотя определение дается одно — первое). Непосредственной движущей силой, обеспечивающей кровоток, является разность кровяного давления между проксимальным и дистальным участком сосудистого русла. Давление крови в сосудах создается работой сердца и зависит от тонуса сосудов и количества крови в них. Препятствует движению крови сопротивление в кровеносной системе, около 20 % которого приходится на аорту, крупные артерии и их ветви; на долю мелких артерий (диаметр менее 100 мкм) и артериол — около 50 %; на долю капилляров — примерно 25 %, на венулы и вены — менее 1 %. Многие авторы отмечают, что общее периферическое сопротивление сосудов (ОПСС; обозначается также буквой «R») зависит от градиента давления (ДР) в начальном и конечном отделах большого круга кровообращения. Однако с такой точкой зрения нельзя согласиться. Напротив, ДР зависит от сопротивления сосудов: чем оно больше, тем больший перепад давления необходим для преодоления этого сопротивления. ОПСС (Р) зависит от вязкости крови, просвета длины сосудов; определяется по формуле Пуазейля: R = 8£т|/(тгг4). Точно рассчитать R сосудистой системы и по этой формуле также невозможно, поскольку L, Т], г подсчитать в организме весьма проблематично; кроме того, Т| зависит не только от свойств крови, но и от г. Ценность этой формулы для изучения гемодинамики заключается лишь в том, что она демонстрирует факторы, от которых зависит R. Градиент же давления в эластичных сосудах организма не отражает ОПСС, поскольку сердце, создающее давление в начале аорты, не преодолевает ОПСС. Оно преодолевает величину гидростатического давления в аорте. Выбрасываемая левым желудочком порция крови размещается в начальном отделе аорты (то же самое и в легочной артерии) за счет ее растяжения вследствие эластичности стенок аорты, а дальше кровь движется во время диастолы желудочков за счет эластической тяги аорты и артерий — вазоэффект. Поэтому нельзя рассчитывать ОПСС по формуле: R = &P/Q (Q— объемная скорость кровотока). По этой же причине нельзя рассчитывать и 0 по формуле: Q = &P/R. Точная формула для определения Q пока еще не разработана. ОПСС огромно, но сердце его не преодолевает и преодолеть не смогло бы (подробнее — см. п. 11.9). Таким образом, анализ этих формул свидетельствует о том, что их следует исключить из раздела «Гемодинамика» в литературе по физиологии. В системе кровообращения длина сосудов довольно постоянна, а радиус ' сосуда и вязкость крови — переменные параметры. Причем наиболее изменчивым является радиус сосуда, именно он вносит главный вклад в создание сопротивления току крови при различных состояниях организма, так как величина сопротивления зависит от радиуса сосуда, возведенного в четвертую степень. Включение для кровотока не функционирующих в данный момент капилляров равноценно расширению сосудистого русла. Вязкость крови связана с содержанием в ней белков и форменных элементов. Эти показатели могут изменяться при различных состояниях организма (анемия, полицитемия, ги- перглобулинемия). Вязкость крови снижается при уменьшении диаметра трубки ниже 0,3 мм вследствие того, что эритроциты начинают двигаться в быстром центральном потоке крови, плазма у стенок капилляра движется медленнее, что уменьшает силу трения. Кроме того, эритроциты легко деформируются, что улучшает их прохождение через узкие сосуды. Из-за большого сопротивления току крови в артериолах, которое к тому же может значительно изменяться при их сужении или расширении, артериолы называют «кранами» сосудистой системы. В условиях физиологического покоя почти во всех отделах кровеносной системы наблюдается ламинарное, т.е. слоистое, течение крови, без завихрений и перемешивания слоев. Вблизи стенки сосуда располагается слой плазмы, скорость движения которого ограничивается неподвижной поверхностью стенки сосуда (она приближается к нулю); по оси сосуда с большей скоростью движется слой эритроцитов. Слои скользят относительно друг друга, что создает сопротивление (трение) току крови как гетерогенной жидкости. Между слоями возникает напряжение сдвига, которое тормозит движение более быстрого слоя. В капиллярах вязкость крови снижается в 2 раза, что объясняется особенностями движения эритроцитов: они скользят, двигаясь друг за другом (по одному в цепочке) в «смазочном» слое плазмы и деформируясь в соответствии с диаметром капилляра. При турбулентном движении крови сопротивление возрастает. Турбулентное течение наблюдается в проксимальных отделах аорты и легочного ствола в период изгнания крови из сердца, локальные завихрения могут создаваться в местах разветвлений и сужений артерий, в области крутых изгибов последних. Движение крови может стать турбулентным во всех крупных артериях при возрастании объемной скорости кровотока (например, при интенсивной мышечной работе) или снижении вязкости крови (при выраженной анемии). Поперечное сечение сосудов. Наименьшую площадь поперечного сечения всего кровеносного русла имеет аорта — 3—4 см2. По ходу артериального русла суммарное поперечное сечение его все возрастает, так как каждая артерия дихотомически делится. Самая большая суммарная площадь поперечного сечения у капилляров. Затем оно уменьшается по направлению к сердцу, так как венулы собираются и образуют вены, которые, в свою очередь, сливаются в полые вены (табл. 11.1). Таблица 11.1 Основные показатели сердечно-сосудистой системы
Объемная скорость кровотока (количество крови, протекающее через поперечное сечение сосуда в единицу времени). В сердечно-сосудистой системе она составляет 4—6 л/мин (МВ) и распределяется по регионам и органам в зависимости от интенсивности их метаболизма (при активном состоянии тканей кровоток в них может возрастать в 2-20 раз). На 100 г ткани объем кровотока в покое равен: в мозге — 55 мл/мин, в сердце — 80, в печени — 85, в почках — 400, в скелетных мышцах — 3 мл/мин. Распределение общего объема крови в различных отделах сердечно-сосудистой системы представлено в табл. 11.2. Таблица 11.2
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-12; просмотров: 104; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.15.91 (0.019 с.) |