Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общее количество газов в крови, мл/лСодержание книги
Поиск на нашем сайте
В виде физического растворения транспортируется только 3 мл/л О2, что крайне мало по сравнению с потребностями организма. Однако эта фаза весьма важна, так как О2 из капилляров к тканям, и О2 из альвеол в кровь и в эритроцит проходит через физическое растворение. Если учесть, что человек некоторое время может дышать чистым О2 при давлении до 3 атм, можно добиться увеличения физически растворенного О2 до 68 мл/л, что и используется в клинической практике при оперативных вмешательствах на сердце или при сердечно-легочной недостаточности. В покое ткани получают достаточно О2 при наличии его в количестве 50 мл/л. Но даже дыхание с помощью газообменной маски чистым кислородом при обычном для человека давлении в 1 атм увеличивает количество физически растворенного О2 до 23 мл/л и несколько улучшает снабжение организма кислородом в условиях патологии. В условиях нормального дыхания практически весь О2 переносится кровью в виде химического соединения с гемоглобином. Характеристика гемоглобина. Гемоглобин — это хромопротеид, имеющий молекулярную массу 64 500 Да и состоящий из белка глобина и четырех одинаковых групп гемов. Гем представляет собой протопорфирин, в центре которого расположен ион двухвалентного железа, играющий ключевую роль в переносе О2. Содержание гемоглобина в крови у мужчин составляет 130—160 г/л, у женщин — 120-140 г/л. Гемоглобин обладает замечательным свойством присоединять О2, когда кровь находится в легком, и отдавать О2, когда кровь проходит по капиллярам всех органов и тканей организма. После разрушения старых эритроцитов в норме и в результате патологических процессов дыхательная функция гемоглобина прекращается, поскольку он частично «теряется» через почки, выводится с желчью, частично фагоцитируется клетками мононукле- арной фагоцитирующей системы. Соединения гемоглобина Оксигемоглобин — обратимая связь гема с кислородом (оксигенация), причем валентность железа не изменяется. При этом восстановленный гемоглобин (НЬ) становится оксигенированным — НЬО2, а точнее, НЬ(О2)4. Каждый гем присоединяет по одной молекуле кислорода, поэтому одна молекула гемоглобина максимально связывает четыре молекулы О2. Количество О2, которое может быть связано в 1 л крови, у мужчин составляет 180—200 мл/л (кислородная емкость крови), у женщин — на 10—20 % меньше так как у них меньше НЬ.
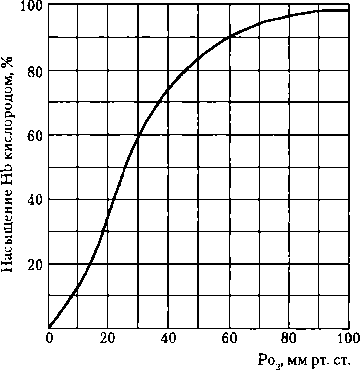
Карбоксигемоглобин —соединение с угарным газом (СО). Поскольку сродство гемоглобина к СО в 300 раз больше, чем к О2, и НЬСО диссоциирует в 10 тыс. раз медленнее, чем НЬО2, гемоглобин, связанный с СО, не может транспортировать О2. Даже при крайне низких парциальных давлениях СО гемоглобин превращается в карбоксигемоглобин: НЬ + СО = НЬСО. В норме на долю НЬСО приходится лишь 1 % общего количества гемоглобина крови, у курильщиков — значительно больше: к вечеру оно достигает 20 %. Если в воздухе содержится 0,1 % СО, то около 80 % гемоглобина переходит в карбоксигемоглобин и выключается из транспорта О2. Опасность образования большого количества НЬСО подстерегает пассажиров на автомобильных дорогах. Известно много случаев со смертельным исходом при включении двигателя автомобиля в гараже в холодное время года с целью обогрева. Первая помощь пострадавшему заключается в немедленном прекращении его контакта с угарным газом. Специфическое лечение — дыхание чистым кислородом, особенно эффективно под повышенным давлением; поступление кислорода в кровь ускоряет диссоциацию НЬСО. Метгемоглобин (гемоглобин при истинном окислении гема) — двухвалентное железо превращается в трехвалентное. Окисленный гем носит название гематина (метгема). Опасность таких состояний заключается в том, что окисленный гемоглобин очень слабо диссоциирует (не отдает О2 тканям) и, естественно, не может присоединять дополнительно молекулы О2, т.е., он теряет свои свойства переносчика кислорода. В крови человека в норме метгемоглобин содержится в незначительных количествах, но при некоторых заболеваниях, отравлениях определенными ядами, при действии некоторых лекарств, например кодеина, фенацетина его содержание увеличивается. Карбогемоглобин — соединение гемоглобина с СО2(ННЬСО2). Образование оксигемоглобина. Связывание кислорода гемоглобином происходит в капиллярах легких. Гл а в н ы м фактором, обеспечивающим образование оксигемоглобина, является высокое парциальное давление О2 в альвеолах (100 мм рт. ст.; рис. 10.6). Оксигенация происходит очень быстро. Время полунасыщения гемоглобина кислородом составляет всего лишь 0,01 с (длительность пребывания крови в капиллярах легких — в среднем 0,5 с). Пологий характер кривой в верхней ее части образования и диссоциации оксигемоглобина (см. рис. 10.6.) свидетельствует о том, что в случае значительного падения Ро2 в легких содержание О2 в крови сохранится достаточно высоким. Так, даже при падении Ро2 в легких до 60 мм рт. ст. (8,0 кПа) насыщение гемоглобина кислородом равно 90 % — это весьма важный биологический факт: организм все еще будет обеспечен О2, т.е. имеется высокая надежность механизмов обеспечения организма кислородом, что весьма важно для человека при жизни в горах, полетах на низких высотах — до 3 км.
Не только образование оксигемоглобина в легких, но и диссоциация его в тканях проходит в пределах одного и того же верхнего участка кривой
Рис. 10.6. Кривая образования и диссоциации оксигемоглобина при pH = 7,4 и t = 37 °C
(75-96 % насыщения гемоглобина кислородом). В венозной крови, поступающей в капилляры легких, Ро2 равно 40 мм рт. ст., а в артериальной крови достигает 100 мм рт. ст., как Ро2 в альвеолах. В условиях эксперимента с увеличением Ро2от 0 до 40 мм рт. ст. насыщение гемоглобина кислородом вначале идет очень быстро, а затем оно сильно замедляется (см. рис. 10.6, нижняя часть кривой). Имеется ряд вспомогательных факторов, способствующих оксигенации крови: 1) отщепление от карбогемоглобина СО2 и удаление его (эффект Вери- го); 2) понижение температуры в легких; 3) увеличение pH крови (эффект Бора). Диссоциация оксигемоглобина Главным ф а к т о р о м, обеспечивающим диссоциацию оксигемоглобина, является падение Ро2, при быстром потреблении О2 тканями (см. рис. 10.6). Это происходит в тканевых капиллярах, куда поступает артериальная кровь. При этом гемоглобин не только отдает О2 тканям, но и присоединяет образовавшийся в них СО2. В интерстиции Ро2 уменьшается и составляет около 40 мм рт. ст., на поверхности клеток около 20 мм рт. ст., в митохондриях — около 1 % (когда Ро2 в клетке становится равным 0,1 мм рт. ст., клетка погибает). Поскольку возникает большой градиент Ро2 (в пришедшей артериальной крови Ро2 составляет около 95 мм рт. ст.), диссоциация оксигемоглобина идет быстро, и О2 переходит из капилляров в ткань. Длительность полудиссоциации равна 0,02 с (время прохождения каждого эритроцита через капилляр большого круга — около 2,5 с), поэтому имеется огромный запас времени для отщепления О2. Средняя часть кривой имеет крутой наклон, что целесообразно биологически. В случае увеличения потребности в кислороде отдельных органов или организма в целом и увеличения расхода О2 даже небольшое уменьшение напряжения О2 ниже 40 мм рт. ст. ведет к значительному ускорению диссоциации оксигемоглобина и обеспечению кислородом интенсивно работающих органов. Вспомогательные факторы, способствующие диссоциации оксигемоглобина в тканях: 1) накопление СО2 в тканях; 2) закисление среды; 3) повышение температуры тела; 4) увеличение количества 2,3-дифосфоглицерата — промежуточного продукта, который образуется в эритроцитах при расщеплении глюкозы. При гипоксии его образуется больше, что улучшает диссоциацию оксигемоглобина и обеспечение тканей организма кислородом. Ускоряет диссоциацию оксигемоглобина; 5) АТФ. Ускорение диссоциации оксигемоглобина при накоплении СО2 и ионов Н+ в крови объясняется конформационными изменениями белковой части молекулы гемоглобина. Влияние Рсо2 на связь гемоглобина с кислородом открыл отечественный физиолог Б. Ф. Вериго в 1898 г. (эффект Вериго); влияние действия pH было открыто датским физиологом Ч. Бором в 1904 г. (эффект Бора). В зарубежной литературе оба эффекта называют эффектами Бора.
Степень выраженности влияния всех факторов (падение Ро2 и pH, накопление СО2 и повышение температуры органа) возрастает при увеличении интенсивности обмена веществ в активно работающем органе, что биологически целесообразно. При этом каждый 1 л крови, содержащий 180—200 мл О2, отдает тканям около 45 мл О2 — артериовенозная разница по кислороду, что составляет 22—23 %. Эта часть О2, поглощаемая тканями, называется коэффициентом использования кислорода. Около 140 мл О2 остается в каждом литре венозной крови, возвращающейся вновь за кислородом в легкие (это резерв организма). Роль миоглобина в обеспечении мышц кислородом. Молекула миоглобина очень сходна с отдельной субъединицей молекулы гемоглобина. Однако молекулы миоглобина не соединяются между собой с образованием тетрамера, что, по-видимому, объясняет функциональные особенности связывания О2. Сродство миоглобина к О2 больше, чем у гемоглобина: уже при напряжении Ро2 3—4 мм рт. ст. 50 % миоглобина насыщено кислородом, а при 40 мм рт. ст. этот показатель достигает 95 %. Миоглобин труднее отдает кислород. Это своего рода запас О2, который составляет 14 % от общего количества О2, содержащегося в организме. Оксимиоглобин начинает отдавать кислород только после того, как Ро2 падает ниже 10 мм рт. ст. Благодаря этому он играет в покоящейся мышце роль кислородного депо и отдает О2 только тогда, когда исчерпываются запасы оксигемоглобина — в частности, во время сокращения мышцы кровоток в капиллярах может прекращаться в результате их сдавливания, мышцы в этот период используют запасенный во время расслабления кислород. Это особенно важно для сердечной мышцы, источником энергии которой является в основном аэробное окисление. В условиях гипоксии содержание миоглобина возрастает, что также биологически целесообразно. 10.5. Транспорт углекислого газа кровью Соединения СО2, с помощью которых он транспортируется. Углекислый газ, как и кислород, переносится плазмой и эритроцитами (Сеченов И. М., 1859).
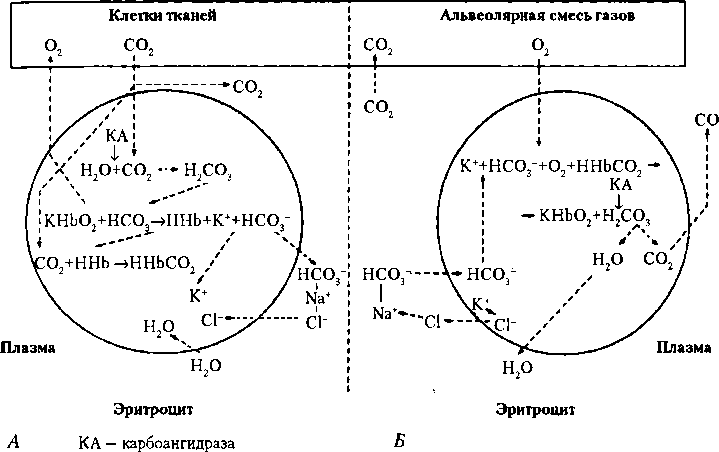
В плазме крови содержится несколько больше 60 % всего СО2, причем в основном в виде бикарбоната натрия (NaHCO3, 340 мл/л), т.е., в виде химической связи, 45 мл/л СО2 — в физически растворенном состоянии и около 15 мл/л СО2 — в виде Н2СО3. Всего в венозной крови содержится около 580 мл/л СО2. При том что Рсо2 ниже, чем Ро2, количество физически растворенного СО2 в 15 раз больше. Это объясняется гораздо более высоким коэффициентом растворимости СО2. Содержание СО2 в крови, как и О2, в физически растворенном состоянии относительно невелико, но это играет важную роль в жизнедеятельности организма. Для того чтобы связаться с теми или иными веществами, дыхательные газы сначала должны быть доставлены к ним в физически растворенном виде. В эритроците содержится свыше 30 % всего СО2, причем в основном в виде карбогемоглобина (ННЬСО2, 55 мл/л) и бикарбоната калия (КНСО3, 140 мл/л). Хотя в виде карбаминовой связи (ННЬСО2) содержится только 55 мл/л СО2 (около 9 % от всего количества СО2 в венозной крови, которое составляет около 580 мл/л), это соединение обеспечивает выделение из организма до 30 % объема всего выделяемого через легкие СО2. Это связано с особенностями соединения ННЬСО2 (Hb-NH-COOH) — легко образуется в эритроцитах при прохождении крови через тканевые капилляры и легко диссоциирует, когда кровь проходит по капиллярам легких. Практически весь СО2, связанный с гемоглобином, покидает организм с выдыхаемым воздухом в результате газообмена в легких. Важно отметить, что некоторое увеличение содержания СО2 в крови оказывает благоприятное влияние на организм: увеличивает кровоснабжение мозга и миокарда, стимулирует процессы биосинтеза и регенерацию поврежденных тканей. Углекислый газ, образуемый в организме, выделяется, в основном, через легкие (около 98 %), только 0,5 % — через почки, около 2 % — через кожу в виде НСО3-бикарбонатов. Образование соединений СО2 происходит во всех тканях организма. В результате окислительных процессов и образования СО2 его напряжение в клетках достигает 60—70 мм рт. ст., что значительно больше, чем в поступающей к тканям артериальной крови (40 мм рт. ст.). Поэтому СО2, согласно градиенту напряжения, из клеток переходит в интерстиций и далее через стенку капилляров — в кровь. Небольшая его часть остается в плазме в виде физического растворения. Образование соединений СО2 ускоряется карбоангидразой, которая находится не в плазме крови, а в эритроцитах. Небольшое количество Н2СО3 (Н2О+СО2—> Н2СО3) образуется также в плазме, но этот процесс идет очень медленно, так как в плазме крови нет фермента карбоангидразы, катализирующего образование Н2СО3. Углекислый газ, проникая в эритроцит, соединяется с водой и очень быстро образует угольную кислоту (процесс катализируется содержащейся в эритроците карбоангидразой примерно в 15 тыс. раз). В тканях с высокой концентрацией СО2 оксигемоглобин (КНЬО2) легко отдает кислород. В этом состоянии он теряет ионы калия и легко принимает от угольной кислоты ионы Н+, превращаясь в гемоглобиновую кислоту (ННЬ). В свою очередь ионы К+ связываются с ионами гидрокарбоната, образуя бикарбонат калия: КНЬО2 + Н2СО3 ННЬ+ КНСО3 + о2.
Присоединяя ион Н+, гемоглобин действует как буферная система, поэтому большое количество Н2СО3 может переноситься к легким без значительного изменения pH внутренней среды организма. СО2 связывается с гемоглобином путем непосредственного присоединения к аминогруппам белкового компонента гемоглобина. При этом образуется так называемая карбаминовая связь: ННЬ + + СО2 = ННЬСО2 (Hb-NH-COOH — карбогемоглобин, а точнее, карбамино- гемоглобин). Основная масса ионов НСО3_, образующихся в эритроцитах, выходит в плазму, взаимодействует там с Na+, образуя NaHCO3 (соединения находятся в диссоциированном состоянии Na+ + НСО3_). Выход НСО3_ из эритроцитов компенсируется поступлением туда СГ, диффундирующего из плазмы. Ион НСО3 выходит из эритроцита согласно концентрационному градиенту, а СГ входит в эритроцит согласно электрическому градиенту (эритроцит внутри имеет положительный заряд). Часть ионов СГ, проникающих в эритроциты,
Угольная кислота и ионы НСО3 образуются также в лейкоцитах и тромбоцитах, поскольку карбоангидраза имеется и в этих клетках. Однако их роль в транспорте СО2 невелика, так как они не содержат гемоглобина, их число значительно меньше, нежели эритроцитов, их размеры очень маленькие (тромбоциты имеют диаметр 2—3 мкм, эритроциты — 8 мкм). Небольшое количество СО2 (1—2 %) переносится белками плазмы крови также в виде карбаминовых соединений. Диссоциация соединений СО2 происходит в легких. В первую очередь начинается выход в альвеолы физически растворенного СО2 из плазмы крови, поскольку Рсо2 в альвеолах (40 мм рт. ст.) ниже, чем в венозной крови (46 мм рт. ст.). Это ведет к уменьшению Рсо2 в крови. Причем присоединение кислорода к гемоглобину ведет к уменьшению сродства углекислого газа к гемоглобину и расщеплению карбогемоглобина (эффект Холдена). Общая схема процессов образования и диссоциации соединений О2 и СО2, а также направление их диффузии представлены на рис. 10.7. Хотя СО2 непрерывно образуется, а О2 потребляется, оптимальное их содержание в организме поддерживается с помощью надежных механизмов регуляции. 10.6. Регуляция дыхания Локализация нейронов дыхательного центра В продолговатом мозге находится главная часть дыхательного центра. Это установлено в опытах с перерезкой ствола мозга, проведенных французским физиологом Легаллуа в 1812 г. При раздражении отдельных структур этой части мозга М. Флуранс примерно в те же годы обнаружил, что разрушение медиальной части продолговатого мозга в нижнем углу ромбовидной ямки ведет к полной остановке дыхания. Отечественный ученый Н.А. Миславский (1885) установил наличие двух структур, ответственных за вдох и выдох (они расположены в обеих половинах продолговатого мозга), взаимодействие которых обеспечивает ритмичное дыхание. Инспираторные нейроны локализуются также в спинном мозге (С,-С2). Совокупность дыхательных нейронов называют генератором ритма дыхания. Мотонейроны спинного мозга являются исполнительными (эффекторами) — они получают импульсы от нейронов продолговатого мозга и посылают их к дыхательным мышцам по межреберным и диафрагмальным нервам. Центры межреберных нервов, иннервирующих мускулатуру грудной клетки, локализуются в грудном отделе спинного мозга (4—10-й сегменты), иннервация мышц живота осуществляется Th4—Ь3-сегментами. Центр диафрагмальных нервов находится, в основном, в 3—5-м шейных сегментах спинного мозга. Нейроны моста при взаимодействии с нейронами продолговатого мозга обеспечивают нормальный цикл дыхания — участвуют в регуляции продолжительности фаз вдоха, выдоха и паузы между ними. Перерезка ствола мозга непосредственно над мостом не изменяет характер генерации дыхательного ритма, при перерезке непосредственно ниже моста вдохи становятся затянутыми, более глубокими. Роль вышележащих отделов ЦНС в регуляции дыхания. Средний мозг играет важную роль в регуляции тонуса всей мускулатуры организма, в том числе и дыхательной. Гипоталамус выполняет интегративную роль в регуляции частоты и глубины дыхания при физической работе. Об участии коры большого мозга в регуляции дыхания, в частности, свидетельствует тот факт, что частоту и глубину дыхания можно изменять произвольно. О роли коры мозга свидетельствует также усиление дыхания перед стартом; минимальная физическая нагрузка (несколько шагов в течение 1—2 мин) у животного без коры в эксперименте вызывает длительную одышку. Благодаря коре большого мозга, при выполнении физических упражнений интенсивность дыхания становится адекватной потребностям организма. Автомашин дыхательного центра — это циркуляция возбуждения в его нейронах, обеспечивающая саморегуляцию вдоха и выдоха. Автоматическую активность дыхательного центра впервые наблюдал с помощью гальванометра на изолированном продолговатом мозге лягушки И.М. Сеченов (1882). С помощью микроэлектродной техники ритмическую активность изолированного продолговатого мозга золотой рыбки зарегистрировал Эдриан (1931). Срез в области локализации основных дыхательных нейронов толщиной всего лишь 0,5 мм продолжает генерировать дыхательный ритм in vitro, что также демонстрирует высокую надежность автоматии дыхательного центра. Основная часть нейронов дыхательного центра в продолговатом мозге относится к РФ, эти нейроны обладают свойством спонтанной активности. Автоматию дыхательного центра поддерживает афферентная импульсация от рефлексогенных зон — от хемо- и механорецепторов, взаимодействие возбуждающих и тормозных влияний нейронов самого дыхательного центра, гуморальные влияния непосредственно на центр (главным образом, СО2). Нейронная организация главной части дыхательного центра. Дыхательными называют нейроны, которые возбуждаются в различные фазы дыхательного цикла. В правой и левой половинах продолговатого мозга имеется по два скопления дыхательных нейронов — дорсальное и вентральное. Нейроны дорсальной группы локализуются в дорсомедиальной части продолговатого мозга, вентральной группы — в вентролатеральных отделах продолговатого мозга. Большинство нейронов дорсальной группы (около90 %) являются инспираторными, они посылают свои аксоны к мотонейронам центра диафрагмального нерва и управляют сокращениями диафрагмы — главной дыхательной мышцы (главным образом, 2—4-й сегменты). Часть нейронов дорсальной группы посылает свои аксоны к нейронам вентральной группы и взаимодействует с ними в саморегуляции вдоха и выдоха. Нейроны вентральной группы подразделяют на две части: ростральная часть состоит из инспираторных нейронов, одна часть которых взаимодействует с другими дыхательными нейронами продолговатого мозга, а другая часть управляет мышцами вдоха с помощью мотонейронов спинного мозга; каудальная часть — состоит из экспираторных нейронов, направляющих свои аксоны в спинной мозг, мотонейроны которого иннервируют внутренние межреберные мышцы (40 %) и мышцы брюшной стенки (60 %). В вентральной группе находятся также нейроны центров блуждающих нервов. Часть дыхательных нейронов продолговатого мозга взаимодействует только с другими нейронами дыхательного центра. Классификация нейронов дыхательного центра (один из вариантов): 1) инспираторные (ранние, возбуждающиеся в начале вдоха, поздние — в конце и полные — в течение всего вдоха); 2) экспираторные (соответственно ранние, поздние и полные); 3) инспираторно-экспираторные\ 4) экспираторно-инспираторные', 5) непрерывно активные', 6) постинспираторные (рис. 10.8). Имеются и другие классификации. Большинство инспираторных нейронов обладает непрерывной спонтанной импульсной активностью. Однако она трансформируется в фазную ритмическую импульсацию, благодаря тормозным реципрокным влияниям поздних инспираторных и экспираторных нейронов. После перерезки блуждающих нервов и ствола мозга между мостом и
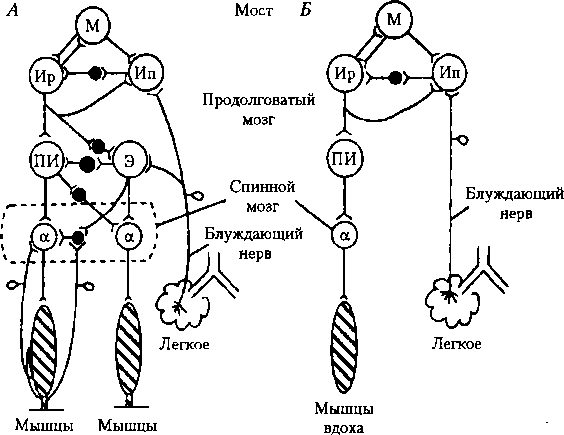
л___ ши____, „_______ I ■НН I s,_______ 111111lllllllllllllllll I 61______ шш Рис. 10.8. Активность основных групп дыхательных нейронов продолговатого мозга в связи с фазами дыхательного цикла (по Б. И. Ткаченко, 1994, с изменениями): А — вдох; Б — выдох. Нейроны инспираторные: 1 — ранние, 2 — полные, 3 — поздние; экспираторные: 4 — ранние, 5 — полные, 6 — поздние Большинство экспираторных нейронов являются антиинспираторными, и только часть из них посылает свои импульсы к мышцам выдоха. Они возбуждаются под влиянием нейронов моста и афферентной импульсации блуждающих нервов.
Взаимодействие нейронов дыхательного центра. Ритмическое сокращение и расслабление дыхательных мышц обеспечивается циркуляцией возбуждения в дыхательных нейронах продолговатого мозга (главной части дыхательного центра), а также взаимодействием импульсации нейронов продолговатого мозга с импульсацией дыхательных нейронов моста и рефлексогенных зон, главной из которых является легочная. При этом эфферентные импульсы ритмично поступают по диафрагмальному и межреберным нервам к мышцам вдоха, что ведет к их сокращению и вдоху. Прекращение импульсации сопровождается расслаблением дыхательной мускулатуры, в результате чего осуществляется выдох — при форсированном дыхании включаются и мышцы выдоха. Саморегуляция вдоха и выдоха осуществляется благодаря циркуляции возбуждения в дыхательном центре и взаимного возбуждения и торможения нейронов (рис. 10.9). Дыхательный цикл начинается с возбуждения ранних инспираторных нейронов. Далее возбуждение переходит на полные инспираторные нейроны (ПИ на рис. 10.9). В процессе циркуляции возбуждения импульсы по возвратным связям поступают к предшествующим нейронам и тормозят их. Полные инспираторные и экспираторные нейроны по нисходящим путям посылают импульсы к мотонейронам спинного мозга, иннервирующим дыхательную мускулатуру. На рис. 10.9 отражены основные данные о механизме саморегуляции вдоха и выдоха. Роль моста в регуляции вдоха и выдоха доказана в опытах с перерезкой ствола мозга (Люмсден, 1923): при отделении моста вдохи становятся очень длительными, прерываются короткими выдохами. При перерезке блуждающих нервов дыхание нарушается меньше, но оно становится резко замедленным и глубоким, вдох продолжается больше обычного. Таким образом, импульсация от нейронов моста и афферентная импульсация, поступающая в продолговатый мозг по блуждающим нервам, способствуют смене вдоха на выдох. Схема саморегуляции вдоха и выдоха, представленная на рис. 10.9, не отражает ряд известных в настоящее время процессов взаимодействия дыхательных нейронов моста, продолговатого мозга и афферентных импульсов от рефлексогенных зон, но она хорошо иллюстрирует основные процессы механизмов саморегуляции вдоха и выдоха. Показаны три источника импульсов, обеспечивающих смену вдоха на выдох, торможение инспираторных нейронов (Ир и И): 1) от нейронов моста (М); 2) от рецепторов легких, импульсация от которых поступает по блуждающим нервам', 3) от самих инспираторных нейронов (Ир и И). Значение блуждающих нервов в саморегуляции дыхательного цикла установили Геринг и Брейер в опыте с раздуванием легких воздухом в различные фазы дыхательного цикла — раздувание легких воздухом тормозит вдох, после чего наступает выдох. Уменьшение объема легких (забор воздуха) тормозит выдох, ускоряет вдох. После перерезки блуждающих нервов раздувание легких не изменяет характер дыхания. Во время вдоха вследствие растяжения легких возбуждаются их механорецепторы (рецепторы растяжения — они локализуются в стенке трахеи и бронхов). Афферентные импульсы по блуждающим нервам поступают к дыхательным нейронам, тормозят вдох и способствуют смене вдоха на выдох (рефлекс Геринга—Брейера). При этом возбуждаются экспираторные и поздние инспираторные нейроны, которые, в свою очередь, тормозят ранние инспираторные нейроны. Импульсация от проприорецепторов усиливает сокращение дыхательной мускулатуры и способствует смене вдоха на выдох. Причем главную роль играют мышечные и сухожильные рецепторы межреберных мышц и мышц брюшной стенки, которые содержат большое количество этих рецепторов.
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-12; просмотров: 84; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.130.63 (0.017 с.) |