
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярная теплоемкость газа.Содержание книги
Поиск на нашем сайте
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δ Q, полученного телом, к соответствующему приращению его температуры δ T:
Единица измерения теплоёмкости в системе СИ — Дж/К. Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость. Теплоёмкость для различных состояний вещества Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа). Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоёмкость идеального газа с i степенями свободы при постоянном объёме равна:
R ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная. А при постоянном давлении
Удельные теплоёмкости многих веществ приведены в справочниках обычно для процесса при постоянном давлении. К примеру, удельная теплоёмкость жидкой воды при нормальных условиях — 4200 Дж/(кг·К); льда — 2100 Дж/(кг·К). Термодинамика Первое начало термодинамики Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем. Существует несколько эквивалентных формулировок первого начала термодинамики В любой изолированной системе запас энергии остаётся постоянным.[2] Это — формулировка Дж. П. Джоуля (1842 г.). Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты Q, сообщённому системе, в сумме с изменением энергии, связанной сколичеством вещества N при химическом потенциале μ, и работы A '[3], совершённой над системой внешними силами и полями, за вычетом работы A, совершённой самой системой против внешних сил Δ U = Q − A + μΔ N + A '. Для элементарного количества теплоты δ Q, элементарной работы δ A и малого приращения dU внутренней энергии первый закон термодинамики имеет вид: dU = δ Q − δ A + μ dN + δ A '. Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил. Важно заметить, что dU и dN являются полными дифференциалами, а δ A и δ Q — нет. [править]Частные случаи Рассмотрим несколько частных случаев: 1. Если δ Q > 0, то это означает, что тепло к системе подводится. 2. Если δ Q < 0, аналогично — тепло отводится. 3. Если δ Q = 0, то система не обменивается теплом с окружающей средой и называется адиабатически изолированной. Обобщая: в конечном процессе При отсутствии работы над системой и потоков энергии-вещества, когда δ A ' = 0, δ Q = 0, dN = 0, выполнение системой работы δ A приводит к тому, что Δ U < 0, и энергия системы U убывает. Поскольку запас внутренней энергии U ограничен, то процесс, в котором система бесконечно долгое время выполняет работу без подвода энергии извне, невозможен, что запрещает существование вечных двигателей первого рода. Первое начало термодинамики: § при изобарном процессе
§ при изохорном процессе (A = 0)
§ при изотермическом процессе (Δ U = 0)
Здесь
|
||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 239; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.007 с.) |

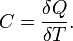
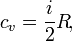
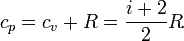
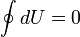
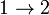 элементарные количества теплоты могут быть любого знака. Общее количество теплоты, которое мы назвали просто Q — это алгебраическая сумма количеств теплоты, сообщаемых на всех участках этого процесса. В ходе процесса теплота может поступать в систему или уходить из неё разными способами.
элементарные количества теплоты могут быть любого знака. Общее количество теплоты, которое мы назвали просто Q — это алгебраическая сумма количеств теплоты, сообщаемых на всех участках этого процесса. В ходе процесса теплота может поступать в систему или уходить из неё разными способами.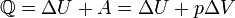
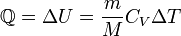
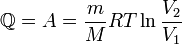
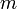 — масса газа,
— масса газа, 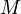 — молярная масса газа,
— молярная масса газа,  — молярная теплоёмкость при постоянном объёме,
— молярная теплоёмкость при постоянном объёме, 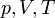 — давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.
— давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.


