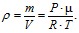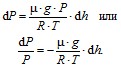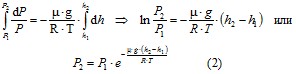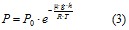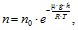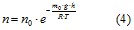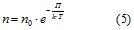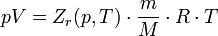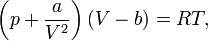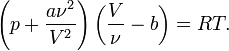Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Параметрическая формула и распределение БольцманаСодержание книги
Поиск на нашем сайте
Молекулы любого газа находятся в постоянном потенциальном поле тяготения Земли. Тяготение с одной стороны и тепловое движение молекул с другой с другой, приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает. Пологая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова, пусть на высоте h атмосферное давление равно P, тогда на высоте h + dh оно равно P + dP. При dh больше нуля dP должно быть меньше нуля, т.к. давление с высотой убывает. Разность давлений P и P + dP равна весу газа, заключенного в объеме цилиндра высотой dh с основанием площадью 1 м2, тогда P– (P + dP) = ρ⋅g⋅dh, где ρ– плотность газа на высоте h, а изменение dh настолько мало, что плотность газа можно считать постоянной, тогда dP = –ρ⋅g⋅dh (1) Из уравнения Менделеева-Клапейрона
Подставим в формулу (1), получим
С изменением высоты от h1 до h2 давление меняется от P1 до P2, тогда
Выражение (2) определяет параметрическую формулу. Если обозначить высоту относительно уровня моря, где давление считается нормальным, тогда выражение (2) можно записать в виде
При P = n⋅k⋅T
где n– концентрация молекул на высоте h. Принимая во внимание, что μ = m0⋅NA, R = k⋅NA, получим
m0⋅g⋅h– это есть потенциальная энергия, тогда
Выражение (5) определяет распределение Больцмана для внешнего потенциального поля. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул. Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана справедливо в любом внешнем потенциальном поле. Распределение Максвелла Реальные газы Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М —молярная масса; R — газовая постоянная.
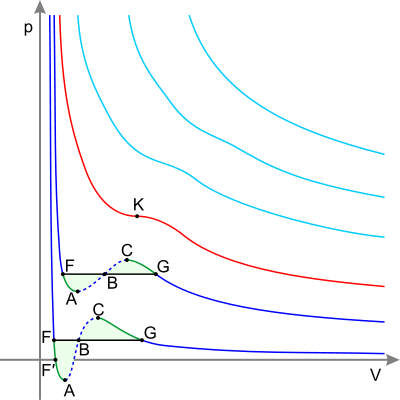
Изотермы реального газа (схематично)
Синие — изотермы при температуре ниже критической. Зелёные участки на них — метастабильные состояния. Участок левее точки F — нормальная жидкость. Красная — критическая изотерма. Голубые — сверхкритические изотермы
Уравнение Ван-дер-Ваальса Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса. Уравнение состояния Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой. Для одного моля газа Ван-дер-Ваальса оно имеет вид:
где § p — давление, § V — молярный объём, § T — абсолютная температура, § R — универсальная газовая постоянная. Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами). Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
где § V — объём,
|
|||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 328; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.110.37 (0.01 с.) |