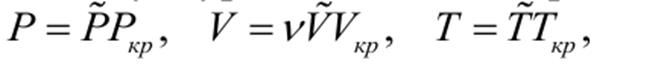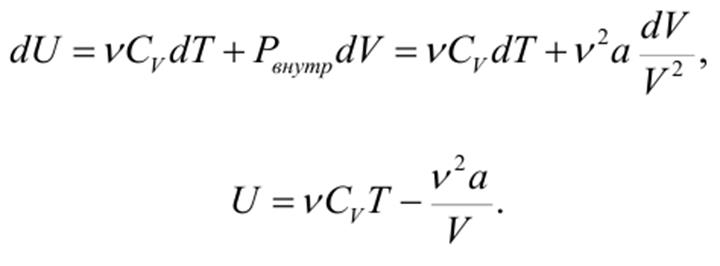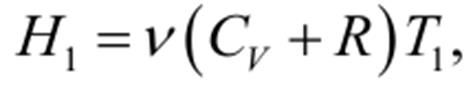Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приведенное уравнения Ван-дер-Вальса. Внутрения энергия газа ванн-дер-Вальса.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Приведенное уравнение ВдВ Делая замену в уравнении Ван-дер-Ваальса:
Получим приведенное уравнение Ван-дер-Ваальса
Видно, что при выборе в качестве единиц критических параметров вещества уравнение ВдВ принимает вид, одинаковый для всех веществ. Отсюда можно заключить, что и поведение различных веществ (в приведенных величинах) одинаково. Это утверждение называется законом соответственных состояний. Формулируется он так: если два приведенных параметра вещества одинаковы, то и третий параметр одинаков. Однако надо заметить, что закон соответственных состояний все же не соблюдается для реальных газов и жидкостей. Отличие результатов К сожалению, простая теория, связанная с использованием уравнения ВдВ не всегда адекватно описывает реальную ситуацию. Основные отличия следующие. 1. Для данного вещества постоянные а и b в уравнении Ван-дер-Ваальса должны быть независимыми от температуры. В действительности же они зависят от температуры. 2. Из соотношения критических параметров следует, что величина
должна быть универсальной постоянной для всех веществ. В действительности же она изменяется.Например, для воды она равна 0,23, а для гелия 0,31. 3. Соотношение V0,кр=3b не соблюдается. Более точным соотношением является V0,кр≈2b. 4. В области двухфазных состояний уравнение Ван-дер-Ваальса не обосновано теоретически и дает расхождения с экспериментом. Внутренняя энергия газа ВдВ Взаимодействие между молекулами газа ВдВ обусловливает их взаимную потенциальную энергию. Поэтому, наряду с величиной νCVdT, в элементарное изменение внутренней энергии газа dU должна входить работа против внутренних сил притяжения dA’= Pвнутр dV. Следовательно, для газа Ван-дер-Ваальса
Эффект Джоуля-Томсана Пропуская реальный газ по теплоизолированной трубке с пористой перегородкой, Джоуль и Томсон обнаружили, что при расширении, которым сопровождается прохождение газа через перегородку, температура его несколько изменяется. В зависимости от начальных давления и температуры изменениеприращения температуры ΔT имеет различные знаки («плюс» или «минус»). Это явление получило название эффекта Джоуля-Томсона. Если температура газа понижается (ΔT <0), эффект называется положительным; если газ нагревается (ΔT >0), эффект называется отрицательным. Пусть индексом «1» выделены, параметры, описывающие начальное состояния газа, а индексом «2» обозначим параметры, соответствующие его конечному состоянию (после расширения) Можно доказать, что в эксперименте Джоуля и Томсона сохраняется энтальпия, т.е. выполняется условие
Таким образом, знак эффекта Джоуля-Томсона определяется знаком выражения, стоящего в квадратных скобках. - эффект получается нулевым. Следует заметить, что эффект Джоуля-Томсона всецело обусловлен отклонениями газа от идеальности. Для идеального газа энтальпия H1 имеет вид
а условие равенства энтальпий принимает вид
Т.е. эффект является нулевым.
Переход из газообразного в жидкое. Экспериментальные изотермы. Насыщенный пар Если покинувшие жидкость молекулы удаляются из пространства вблизи поверхности жидкости, то в конце концов вся жидкость испарится. Если же молекулы, покинувшие жидкость, не удаляются, а удерживаются в замкнутом объеме около поверхности жидкости, то дальнейший процесс развивается по-другому. Покинувшие жидкость молекулы образуют пар. Молекулы пара, попавшие в область вблизи поверхности жидкости, силами притяжения втягиваются в жидкость. Таким образом, скорость испарения уменьшается. При дальнейшем увеличении плотности пара достигается такая ситуация, когда число молекул, покидающих жидкость за некоторое время, равно числу молекул, возвращающихся в жидкость за то же время. Наступает состояние динамического равновесия. Пар в состоянии динамического равновесия с жидкостью называется насыщенным. С увеличением плотности насыщенных паров поверхностное натяжение жидкости уменьшается, поскольку силы, направленные внутрь жидкости, уменьшаются ввиду роста противоположно направленных сил со стороны насыщенного пара. Отсюда же следует, что скрытая теплота парообразования с повышением температуры уменьшается. При критической температуре плотность насыщенных паров становится равной плотности жидкости и различие между ними исчезает. Это означает, что и поверхность исчезает, и, следовательно, поверхностное натяжение и скрытая теплота парообразования при критической температуре обращаются в нуль. При конденсации пара в жидкость его молекулы взаимно притягиваются, в результате чего их скорости, а следовательно, и их кинетическая энергия возрастают. Это ведет к нагреванию образующейся жидкости: теплота, затраченная при испарении, отдается обратно при конденсации пара.
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 604; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.27.132 (0.008 с.) |