
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа.Первое начало термодинамики.Равновесные и неравновесные процессы.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Работа. Для того чтобы уменьшить объем, занимаемый газом, надо совершить работу по преодолению сил давления газа. Представим себе газ, заключенный в цилиндрический объем с поршнем, движением которого изменяется объем газа. Сила, создаваемая давлением р газа на поршень площади S, равна pS, следовательно, работа, совершаемая при перемещении поршня, равна pSdx = pdV, где dV— изменение объема газа. Условились, что работа, производимая внешними силами над газом, имеет отрицательный знак, а работа, производимая газом при увеличении его объема, имеет положительный знак. Поэтому работа бА газа при изме- нении его объема на dV
Параметры, изменение которых обусловливает совершение работы, обозначим малом изменении параметра Полная работа, совершаемая при изменении всех параметров,
При переносе заряда dq между двумя точками с разностью потенциалов ф совершается работа
где ф — абсолютное значение разности потенциалов; заряд dq переносится в направлении роста потенциала. Этот пример иллюстрирует то положение, что обобщенные силы и координаты могут ничем не напоминать обычные силы и координаты. Первое начало термодинамики. Закон сохранения энергии для теплоты как формы энергии, внутренней энергии и совершаемой работы с учетом условия о знаках этих величин может быть записан в следующей очевидной форме:
Закон сохранения энергии в виде называется первым началом термодинамики. В большей части последующего изложения рассматривается работа, связанная с силами давления и изменения объема, и поэтому первое начало будет записываться в виде
Процессы. Процессом называется переход системы из одного равновесного состояния в другое. Неравновесные процессы. Пусть, например, надо перейти в состояние с другим объемом. Ясно, что если это сделать не очень медленно, то постоянство давления по объему нарушится и нарушится также постоянство температуры. Нельзя будет вообще говорить о каких-либо определенных давлении и температуре, поскольку они во всех точках будут различными. Больше того, распределение давления и температуры по объему зависит не только от начального и конечного объемов, но и от способа, которым этот переход осуществляется. Таким образом, промежуточные состояния при таком процессе являются неравновесными. Такой процесс называется неравновесным. Равновесные процессы. Можно осуществить переход другим способом — бесконечно медленно. После каждого бесконечно малого изменения параметров следующее изменение не производится до тех пор, пока система не придет в равновесное состояние, когда все макроскопические параметры примут во всей системе постоянные значения. После этого совершается следующий шаг и т. д. Таким образом, весь процесс состоит из последовательности равновесных состояний. Такой процесс называется равновесным Его можно изображать на диаграммах в виде непрерывных кривых. В уравнении состояния идеальных газов pVm = RT любые из двух параметров могут считаться независимыми параметрами, характеризующими процесс. Например, некоторый процесс перехода от состояния р1V1, в состояние р2, К2. Температура в каждой точке процесса однозначно определяется уравнением состояния. Обратимые и необратимые процессы. Обратимым называется процесс, для которого возможен обратный переход из конечного состояния в начальное через те же промежуточные состояния, что и в прямом процессе. Необратимым называется процесс, когда обратный переход через геже промежуточные состояния невозможен. Очевидно, что неравновесный процесс в принципе не может быть обратимым; он всегда необратим. С другой стороны,равновесный процесс является всегда обратимым. Однако не следует думать, что понятие обратимого процесса равнозначно понятию бесконечно медленного процесса. Можно указать бесконечно медленные необратимые процессы, например пластическая деформация твердых тел может происходить бесконечно медленно и тем не менее не является обратимым процессом.
22.Изопроцессы в идеальном газе.Работа при изопроцессах. Изобарический процесс. Это процесс, происходящий при постоянном давлении: р = = const. Температуры в точках р1V1 и p2V2 определяются уравнением состояния и равны соответственно Т1 = PiV1/R, Т2 = P2V2/R. При этом процессе с увеличением объема к системе необходимо подводить теплоту, для того чтобы обеспечить постоянство давления. Работа в процессе определяется интегралом
Изохорическии процесс. Это процесс, осуществляемый при постоянном объеме: V— const.Работа в этом процессе равна нулю:
Изотермический процесс. Это процесс, осуществляемый при постоянной температуре: Т= const
В этом процессе внутренняя энергия идеального газа не изменяется, так как Т— const и, следовательно, dU = 0. Поэтому на основе первого начала термодинамики бQ = бА Это означает, что в изотермическом процессе все количество теплоты, подводимое извне, идет на совершение работы. Адиабатический процесс. Это процесс, при котором отсутствует теплообмен с окружающей средой. Поэтому первое начало термодинамики для этого процесса записывается в виде
После проведения расчетов работа при адиабатическом процессе будет равна.
Политропический процесс. Процесс, в котором теплоемкость является постоянной величиной, называется политропическим. Уравнение политропы. Из требования, чтобы теплоемкость С была постоянной в процессе, следует, что первое начало термодинамики должно иметь вид
Это уравнение политропы в переменных Т, V. Исключая из него Т с помощью равенства Т= pV/R, находим
Где
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 437; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.165.234 (0.007 с.) |

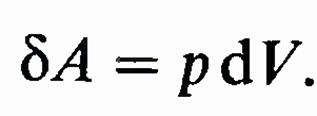
 При бесконечно
При бесконечно совершается работа
совершается работа  где fi — обобщенная сила.: если работа совершается над системой, то знак бА должен быть положительным.
где fi — обобщенная сила.: если работа совершается над системой, то знак бА должен быть положительным.



 \
\






 -показатель политропы.
-показатель политропы.


