Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительные и восстановительные реакции органических соединенийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
(С-Н, С-С и С=С связей в органических соединениях) Окислительно-восстановительные реакции занимают важнейшее значение для процессов жизнедеятельности. С их помощью организм удовлетворяет свои энергетические потребности, поскольку при окислении органических веществ происходит высвобождение энергии. С другой стороны эти реакции служат для превращения пищи в компоненты клетки. Реакции окисления способствуют детоксикации и выведению лекарственных средств из организма. Окисление – процесс удаления водорода с образованием кратной связи или новых более полярных связей Восстановление – процесс обратный окислению. Окисление и восстановление необходимо рассматривать по отношению к определенным классам соединений. Окисление С – Н связей (алканов и алкилов) При полном сгорании алканов образуется СО2 и Н2О, при этом выделяется тепло. Другие пути их окисления и восстановления можно представить следующими схемами: Окисление насыщенных углеводородов протекает в жестких условиях (хромовая смесь горячая), более мягкие окислители не действуют на них. Промежуточными продуктами окисления являются спирты, альдегиды, кетоны, кислоты. Например: при окислении С-Н связи первичного атома углерода образуется спирт,затем альдегид и кислота.
[о][о][о]
НОН
этан этанол этаналь этановая кислота Первичный С
при окислении С-Н связи вторичного атома углерода образуется кетон
Н Пропан ацетон Вторичный С при окислении С-Н связи третичного атома углерода образуется третичный спирт
СН3 СН3
СН3 СН3 Изобутан трет-бутиловый спирт Третичный С Гидропероксиды R – О – ОН важнейшие промежуточные продукты окисления С – Н связей в мягких условиях, в частности in vivo (в организме) Важной реакцией окисления С – Н связей в условиях организма является ферментативное гидроксилирование
Фермент: Никотинамидадениндинуклеотида фосфат(НАДФ) Примером может быть получение спиртов при окислении пищи. За счет молекулярного кислорода и его активных форм. осуществляется в in vivo.
Избыток перекиси должен разлагаться с помощью каталазы на воду и кислород. Окисление и алкенов можно представить следующими превращениями: В мягких условиях:
В жестких условиях:
В жёстких условиях окисление протекает с разрывом двойной связи. При окислении 2-метилбутен-2 образуется кетон и карбоновая кислота. Восстановление алкенов
Окисление аминов in vivo Фермент: Флавинадениндинуклеотид(ФАД)
Биогенный аминальдегид Cравнительная характеристикаокислительно-восстановительных свойств органических соединений.Наиболее легко окисляются тиолы и 2-х-атомные фенолы. Достаточно легко окисляются альдегиды. Труднее окисляются спирты, причем первичные легче, чем вторичные, третичные. Кетоны устойчивы к окислению или окисляются с расщеплением молекулы с образованием кислот. Алкины окисляются легко даже при комнатной температуре.Наиболее трудно окисляются соединения, содержащие атомы углерода в sp3-гибридизированном состоянии, то есть связь у насыщенного атома углерода. ЭД – заместители облегчают окисление(+I,+М): алкильные группы R, -О-, -NH2, -NHR, -NR2, -ОR.
Табл.5
ГЛАВА6. УГЛЕВОДЫ 6.1.Моносахариды, классификация. Углеводы наряду с белками и липидами являются важнейшими химическими соединениями, входящие в состав живых организмов. Структурной основой углеводов являются моносахариды и их производные, соединенные О - гликозидными связями. Углеводы выполняют функции: энергетическую, структурную, защитную, а также углеводы входят в структуру ДНК и РНК и нуклеотидных коферментов. Углеводы образуются в процессе сложной реакции фотосинтеза в растениях с участием хлорофилла:
Метаболизм можно представить реакцией:
Согласно современной классификации углеводы подразделяются на три основные группы. 1.Моносахариды 2.Дисахариды, восстанавливающие и невосстанавливающие (мальтоза, целлобиоза, сахароза, лактоза). 3.Полисахариды; крахмал, целлюлоза, гликоген, декстраны, полигалактуроновая кислота. Моносахариды классифицируются по: а) характеру карбонильной группы на альдозы и кетозы; б) по числу С в цепи на тетрозы,пентозы,гексозы. Следовательно моносахариды делятся на альдотетрозы, альдопентозы, альдогексозы.
Альдозы
Н-С=О Н -С =О Н-*С-ОН Н- *С - ОН Н-*С-ОН Н -*С -ОН Н-*С-ОН СН2ОН СН2-ОН альдотетрозы альдопентозы и т.д.
Кетозы
С Н2ОН СН2ОН С=О С= О Н-*С-ОН Н-*С- ОН Н-*С-ОН СН2ОН СН2ОН
кетотетроза кетопентоза и т.д.
Каждый моносахарид содержит несколько хиральных(асимметрических) атомов *С, и для них существуют стереоизомеры, количество определяется по формуле 2n, где n-количество *С. Моносахариды также делят на моносахариды D-ряда и L- ряда. Конкретные названия моносахаридов определяются конфигурацией всех асимметрических атомов углерода, т.е атомы С с четырьмя различными заместителями(обозначают звёздочкой) Отнесение к D - или L - рядам проводится по конфигурации глицеринового альдегида. В природе чаще встречаются моносахариды D – ряда, хотя встречаются и L – ряда.
Н-С=О Н-С=О Н-*С-ОН НО-*С-Н СН2ОН СН2ОН
D - глицериновый альдегид L - глицериновый альдегид
Н-С=О Н-*С - ОН Н-*С - ОН Н-*С - ОН НО -*С - Н СН2ОН L -ряд альдогексоз
Н -С=О Н-*С - ОН Н-*С - ОН Н-*С - ОН Н-*С -О Н СН2ОН. D-ряд альдогексоз
Важнейшие моносахариды и их производные: D -рибоза, D-2-дезоксирибоза, D-ксилоза, D- N-ацетилксилозамин, D-арабиноза, D-глюкоза, D-глюкозамин, D-N-ацетилглюкозамин,D-глюкуроновую кислоту, D-фруктозу, D-галактоза, D-галактозамин,D-манноза.
Н Н Н С=О C=О С=О Н-С-ОН Н-С-ОН Н-С- Н НО-С-Н Н- С-ОН Н-С-ОН Н-С-ОН Н- С-ОН Н-С-ОНН-С-ОН Н- СН2ОН СН2ОН СН2ОН
D-рибоза 2-Дезокси-D –рибоза D -глюкоза
Н Н СН2ОН С=О С=О С=О НО-С-Н Н-С-ОН НО-С-Н НО-С-Н НО-С-Н Н-С-ОН Н-С-ОН Н-С-ОНН-С-ОН Н-С-ОН СН2ОН СН2ОН СН2-ОН
D- ксилоза D-фруктоза D- манноза
Формулы Фишера:
1СНО СНО
6 СН2 ОН СН2 ОН
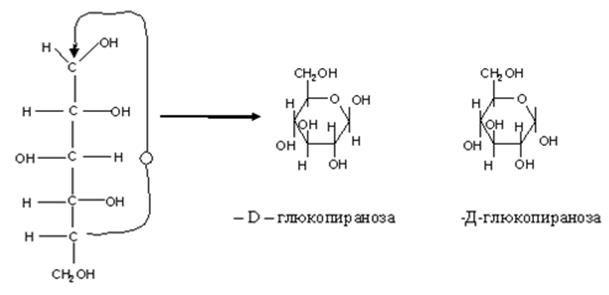
Энантиомеры глюкозы Циклическое строение Атом С-1 становится в результате циклизации асимметрическим, образовавшаяся при циклизации ОН может находиться как над, так и под плоскостью цикла. Эта ОН группа называется полуацетальной (гликозидной), оба стереоизомера не являются зеркальным отражением друг друга, поэтому они диастереоизомеры и называются аномерами. Если ОН находится под плоскостью цикла, то это α- аномер, если над β-аномер. Циклическая полуацетальная форма может образоваться и за счет ОН группы у 4-го С,с образованием пятичленного фуранозного цикла,а при 5-ом пиранозного шестичленного цикла Р Рассмотрим это на примере образования фуранозных форм D-рибозы. Стрелками показано образование связей между атомами Н – О и О – С.
β Приведенные циклические формулы называются формулами Хеуорса (1928г.). В формулах циклический атом кислорода изображают в правом дальнем углу, атом С-1-справа. Группа ОН, которые находились в открытой форме справа, располагаются под плоскостью цикла, а те, что в открытой форме были слева, над плоскостью. Например.
Цикло-оксо-таутомерия.
β α Соотношение таутомеров различное для разных моносахаридов. Более устойчивы пиранозные циклы. Например α-глюкоза в воде постепенно за несколько часов дает смесь α и β-пиранозных циклов в соотношении 1:2. Из β-D – глюкопиранозы образуется смесь того же состава. Равновесие между α и β - аномерами в формулах Хеуорса изображены волнистой линией, как это показано на примере D-глюкуроновой кислоты.
Конформационным строением объясняется соотношение α и β- пиранозных форм D-глюкозы в растворе. Таутомерное равновесие сдвинуто в сторону β-аномера, т.к.наиболее устойчивы аномеры с экваториальным расположением заместителей.
В α-D-глюкозе СН2ОН и все ОН кроме полуацетального ОН занимают экваториальное положение. β-экваториальное положение полуацетального гидроксила в конформации моносахаридов, особенно с учетом конфигурации аномерного центра (α или β) очень важна для пространственного строения полисахаридов. . Эпимерами называются стереоизомеры, отличающиеся конфигурацией только одного атома С, например D- глюкоза и D – манноза эпимеры по С-2; глюкоза и галактоза по С-4.
Дисахариды В организме моносахариды при взаимодействиях спиртовых ОН групп моносахаридов и полуацетального гидроксила образуются олигосахариды (дисахариды): мальтоза, целлобиоза, лактоза сахароза. В организме моносахариды при взаимодействиях спиртовых ОН групп моносахаридов и полуацетального гидроксила образуются олигосахариды: мальтоза, целлобиоза, лактоза, сахароза. Существует два типа связывания моносахаридных остатков в природных дисахаридах. Первый тип связи образуется за счет полуацетальной (гликозидной) ОН-группы одного и любой спиртовой ОН-группы другого моносахарида (восстанавливающие) и второй тип – связь образуется за счет полуацетальных (гликозидных) ОН-групп обоих моносахаридов (невосстанавливающие). Поэтому дисахариды делятся на восстанавливающие дисахариды и невосстанавливающие дисахариды. Восстанавливающие дисахариды: мальтоза, целлобиоза, лактоза. В дисахариде имеется свободная полуацетальная гидроксильная группа, вследствие чего сохраняется способность к раскрытию цикла. Восстановительные свойства таких дисахаридов и мутаротация их свежеприготовленных растворов обусловлены возможностью цикло-оксо-таутомерии. Восстанавливающие дисахариды. Эти дисахариды, также моносахариды, вступающие в реакции с реактивами Толленса, Фелинга или Бенедикта, называют восстанавливающими, т.к. они в связи с наличием альдегидной группы способны восстанавливать в щелочной среде катионы металлов (серебра, меди).
В мальтозе остатки двух молекул D – глюкопиранозы связаны α(1
Мальтоза восстанавливает реактив Фелинга [Сu(ОН)2+ калиево-натриевая соль винной кислоты ],растворы её мутаротируют. Лактоза построена из остатков D –галактопиранозы и D – глюкопиранозы, связанных β(1
В целлобиозе остатки двух молекул D – глюкопиранозы связаны β(1 Растворы целлобиозы мутаротируют, восстанавливают реактив Фелинга или Толленса.
Невосстанавливающие дисахариды. К этой группе принадлежит небольшое число дисахаридов, важнейшим из которых является сахароза. Сахароза построена из остатков D –глюкопиранозы и D – фруктофуранозы, связанных гликозидной связью между гидроксильными группами при аномерных атомах углерода.
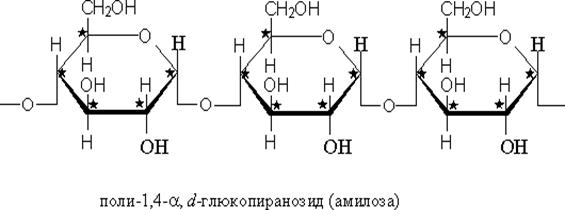
В молекуле сахарозы отсутствуют свободные полуацетальные гидроксильные группы,поэтому отсутствует цикло-оксо-таутомерия. Растворы сахарозы не мутаротируют и не восстанавливают реактив Фелинга или Толленса Полисахариды. Крахмал относится к запасным полисахаридам. Общая формула (С6Н10О5)n –основной запасной полисахарид растений. Образуется в растениях в процессе фотосинтеза, содержится в клубнях, корнях, зернах злаковых культур. Крахмал представляет собой смесь двух гомополисахаридов: амилозы(10-20%) и амилопектина(80-90%)
Крахмал используют в качестве заменителя плазмы крови. Такой плазмозамещающий раствор называют полиглюкин. Целлюлоза (С6Н10О5)n – распространенный растительный полисахарид, представляет собой линейный гомополисахарид, состоящий из остатков ß-D-глюкопираноз, связанных ß -1,4-гликозидными связями. Целлюлоза механически прочна, выполняет роль опорного материала растений. ß-Конфигурация приводит к тому, что цепи имеют линейное строение и возможно образование водородных связей как внутри одной цепи, так и между цепями. Результатом такого строения является механическая прочность. Молекулярная масса целлюлозы велика, составляет ≈1-2 млн. а.е.м., содержит от 2500-12000 глюкозных звеньев. Примером чистой целлюлозы может служить вата.
Целлюлоза не расщепляется ферментами ЖКТ человека, но тем не менее, является необходимым балластным веществом для нормального функционирования ЖКТ. В организме клетчатка выполняет следующие функции: 1) Создает чувство насыщения; 2) Стимулирует перистальтику ЖКТ; 3) Способствует адсорбации токсических веществ в толстом кишечнике и их выведению, что снижает риск развития злокачественных опухолей толстого кишечника и др. Кроме того, в организме происходит образование гликозидов D-глюкуроновой кислоты с некоторыми токсинами и фенольными соединениями. Эти гликозиды выводятся из организма с мочой и осуществляется тем самым детоксикация.Гликозидам родственны их азотсодержащие соединения, которые называются N-гликозидами.N- гликозиды являются компонентами РНК и ДНК. Важнейшее свойство гликозидов это способность подвергаться гидролизу в кислой среде и достаточная устойчивость к гидролизу в щелочной среде. Гидролиз гликозидов – реакция обратная их образованию.
ГЛАВА 7. АМИНОКИСЛОТЫ
|
||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 1033; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.86.191 (0.011 с.) |










 СН3-СН2 -Н СН3 - СН2 - ОН СН3 - С О СН3-С О
СН3-СН2 -Н СН3 - СН2 - ОН СН3 - С О СН3-С О
 СН3 [о] СН3
СН3 [о] СН3




 СН3 С – Н СН3 С О
СН3 С – Н СН3 С О
 [о]
[о]




 Перекись водорода может служить в организме гидроксилирующим агентом (внедрение одного атома кислорода) по связи С-Н).
Перекись водорода может служить в организме гидроксилирующим агентом (внедрение одного атома кислорода) по связи С-Н).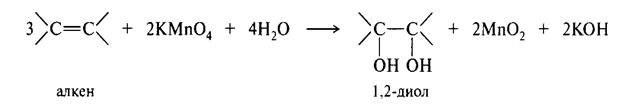


 RCH2NH2 +O2 +H2O R-CHO +NH3 + H2O2
RCH2NH2 +O2 +H2O R-CHO +NH3 + H2O2
 ЭА – затрудняютокисление (-I,-М): F,CI, Br,I, -NO2 ,-NH+3, -NR+3,-SO3H, –COOH, –COOR, C O.
ЭА – затрудняютокисление (-I,-М): F,CI, Br,I, -NO2 ,-NH+3, -NR+3,-SO3H, –COOH, –COOR, C O.
 6СО2 + 6Н2О С 6Н12О6 + 6О2
6СО2 + 6Н2О С 6Н12О6 + 6О2 С 6Н12О6 + 6О2 6СО2 + 6Н2О + Q
С 6Н12О6 + 6О2 6СО2 + 6Н2О + Q


 Н 2 ОН НО Н
Н 2 ОН НО Н
 НО 3 Н Н ОН
НО 3 Н Н ОН
 Н 4 ОН НО Н
Н 4 ОН НО Н Н 5 ОН НО Н
Н 5 ОН НО Н


 α
α

 β α
β α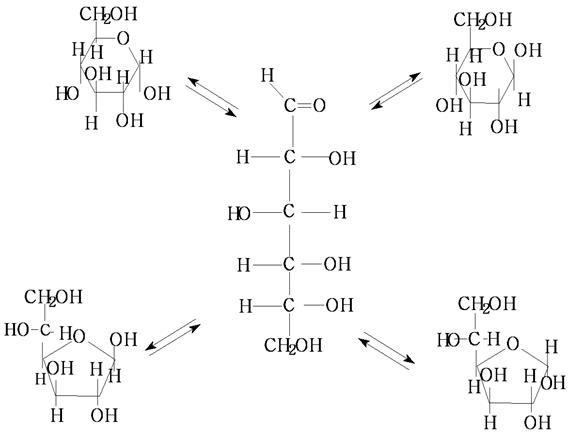


 4) – гликозидной связью.
4) – гликозидной связью.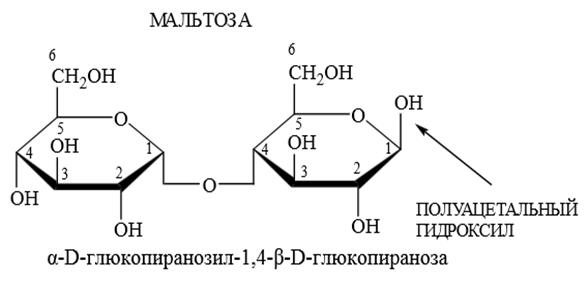
 Растворы лактозы мутаротируют, восстанавливают реактив Фелинга[Сu(ОН)2+ калиево-натриевая соль винной кислоты] или Толленса [Ag(NH3)2]OH.
Растворы лактозы мутаротируют, восстанавливают реактив Фелинга[Сu(ОН)2+ калиево-натриевая соль винной кислоты] или Толленса [Ag(NH3)2]OH.