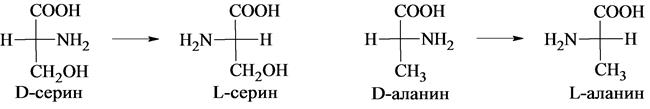Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ароматические и гетероциклические аминокислотыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Современная рациональная классификация основана на полярности радикалов. В этой связи различают: 1. Аминокислоты с неполярными (гидрофобными) радикалами. К ним относятся гидрофобные радикалы аланина, валина, лейцина, изолейцина, пролина, метионина, фенилаланина и триптофана. Радикалы этих аминокислот воду не притягивают, а стремятся друг к другу или к другим гидрофобным молекулам. 2. Аминокислоты с полярными (гидрофильными) радикалами. К ним относятся серин, треонин, тирозин, аспарагин, глутамин и цистеин. В состав радикалов этих аминокислот входят полярные функциональные группы, образующие водородные связи с водой. В свою очередь, эти аминокислоты делят на две группы: 1) способные к ионизации в условиях организма (ионогенные). Например, при рН = 7 фенольная гидроксильная группа тирозина ионизирована на 0,01%; тиольная группа цистеина на 8%.
2) не способные к ионизации (неионогенные) Например, гидроксильная группа треонина:
3. Аминокислоты с отрицательно заряженными радикалами. К этой группе относят аспарагиновую и глутаминовую кислоты. Эти аминокислоты называют кислыми, так как они содержат дополнительную карбоксильную группу в радикале, которая диссоциирует с образованием карбоксилат-аниона. Полностью ионизированные формы этих кислот называют аспартатом и глутаматом:
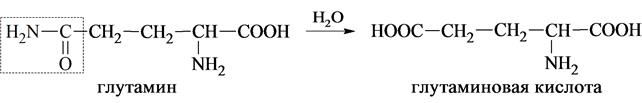
К этой же группе иногда относят аминокислоты аспарагин и глутамин, содержащие карбоксамидную группу (СОNH2), как потенциальную карбоксильную группу, возникающую в процессе гидролиза.
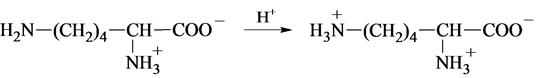
Величины рKa β-карбоксильной группы аспарагиновой кислоты и γ-карбоксильной группы глутаминовой кислоты выше по сравнению с рKa α-карбоксильных групп и в большей степени соответствуют значениям рKa карбоновых кислот. 4. Аминокислоты с положительно заряженными радикалами К ним относят лизин, аргинин и гистидин. У лизина есть вторая аминогруппа, способная присоединять протон:
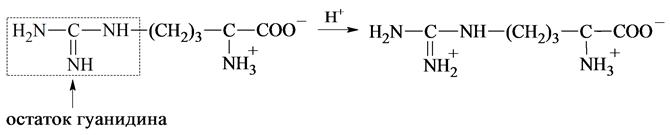
У аргинина положительный заряд приобретает гуанидиновая группа:
Эти аминокислоты называют оснóвными. 7.3 Способы получения α-аминокислот в условиях in vitro, химические свойства 1. Действие аммиака на α-галогенкислоты:
2. Циангидринный синтез:
3. Восстановление α-нитрокислот, оксимов или гидразонов
4. Каталитическое восстановление оксокислот в присутствии аммиака:
Стереоизомерия аминокислот
За исходное соединение, с которым принято сравнивать строение α-аминокислот, условно принимают D- и L-молочные кислоты, конфигурации которых, в свою очередь, установлены по D- и L-глицериновым альдегидам.
Все превращения, которые осуществляются в этих рядах при переходе от глицеринового альдегида к α-аминокислоте, выпол-няются в соответствии с главным требованием они не создают новых и не разрывают старых связей у асимметрического центра. Для определения конфигурации α-аминокислоты в качестве эталона часто используют серин (иногда аланин). Конфигурации их так же выведены из D- и L-глицериновых альдегидов:
Природные аминокислоты, входящие в состав белков, относятся к L-ряду. D-формы аминокислот встречаются сравнительно редко, они синтезируются только микроорганизмами и называются «неприродными» аминокислотами. Животными организмами D-аминокислоты не усваиваются. Интересно отметить действие D- и L-аминокислот на вкусовые рецепторы: большинство аминокислот L-ряда имеют сладкий вкус, а аминокислоты D-ряда горькие или безвкусные. Без участия ферментов самопроизвольный переход L-изомеров в D-изомеры с образованием эквимолярной смеси (рацемическая смесь) осуществляется в течение достаточно длительного промежутка времени. Рацемизация каждой L-кислоты при данной температуре идет с определенной скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, например, в твердой эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст человека или животного. Физические свойства аминокислот Во-первых, в противоположность аминам и карбоновым кислотам аминокислоты представляют собой нелетучие кристаллические вещества, плавящиеся с разложением при близких и довольно высоких температурах, поэтому идентификации аминокислот по температурам плавления достаточно затруднительна. Во-вторых, аминокислоты очень плохо растворимы в неполярных растворителях типа петролейного эфира, диэтилового эфира, бензола и хорошо растворимы в воде. В-третьих, в водных растворах аминокислоты имеют высокие дипольные моменты. В-четвертых, константы кислотности и основности для групп СООН и NH2 необычайно малы. Так, для глицина константа кислотности Ka = 1,6.1010, а константа основности Kb = 2,5.1012; в то время как для большинства карбоновых кислот Ka 105 а для алифатических аминов Kb 104.Все эти свойства вполне объяснимы,если принять во внимание тот факт, что аминокислоты существуют в виде диполярного иона, который образуется за счет отщепления протона от карбоксильной группы и присоединения его к аминогруппе. Диполярный ион часто называют внутренней солью.
Кислотно-основные свойства также становятся понятными, если учесть, что измеряемая Ka в действительности относится к кислотности иона RNH3+:
а константа основности (Kb) в действительности относится к основности карбоксилат-иона.
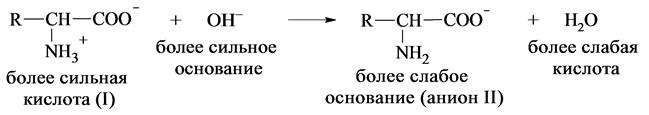
При подщелачивании раствора аминокислоты диполярный ион I превращается в анион II, так как более сильное основание (гидроксильный ион) отрывает протон от иона аммония и образуется более слабое основание амин.
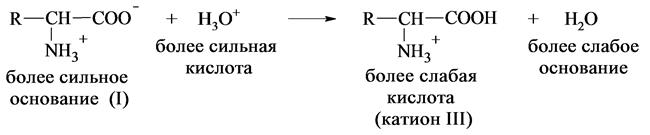
Если подкислить раствор аминокислоты, ион I превратится в катион III, так как более сильная кислота Н3О+ отдает протон карбоксилат-иону и образуется более слабая кислота:
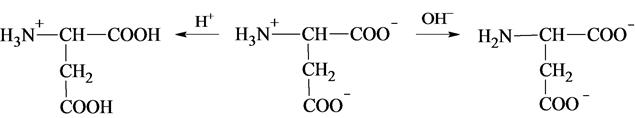
Необходимо отметить, что ионы II и Ш, содержащие свободную аминогруппу или свободную карбоксильную группу, находятся в равновесии с диполярным ионом:
Однако следует иметь в виду, что в данном равновесии участвует также определенное (хотя и небольшое) количество незаряженных молекул аминокислот. Изоэлектрическая точка аминокислот. Если раствор аминокислоты поместить в электрическое поле, то в зависимости от активной реакции среды будет наблюдаться следующая картина: в кислой среде ион аминокислоты мигрирует к катоду, а в щелочной к аноду. Если при определенном рН среды концентрация катионов станет равной концентрации анионов, то никакого движения аминокислоты происходить не будет.
Табл.8
Концентрация ионов водорода (pH), при которой аминокислота не перемещается в электрическом поле, называется изоэлектрической точкой данной аминокислоты (рI). Изоэлектрическая точка аминокислоты зависит от кислотности группы NH3+, основности карбоксилат-аниона, природы радикала и присутствия в молекуле кислоты любой дополнительной основной или кислотной группы.При пропускании постоянного тока через раствор, содержащий смесь нескольких аминокислот, каждая из них будет двигаться к катоду или к аноду со скоростью, зависящей от природы этой аминокислоты и от рН среды. Разделение и анализ смесей амино-кислот, основанное на этом явлении, называется электрофорезом. Химические свойства аминокислот. Амфотерность аминокислот. Наличие в молекуле аминокислоты функциональных групп кислотного и основного характера обусловливает амфотерность аминокислот. Подобно любому амфотерному соединению, аминокислоты образуют соли как при действии кислоты, так и при действии щелочи.
Аминокислоты, будучи гетерофункциональными соединениями, должны проявлять свойства как одной, так и другой функциональной группы.
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 1168; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.145.109 (0.009 с.) |


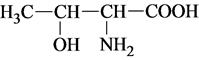


 Один из атомов азота в имидазольном кольце гистидина содержит неподеленную пару электронов, которая также может присоединять протон:
Один из атомов азота в имидазольном кольце гистидина содержит неподеленную пару электронов, которая также может присоединять протон: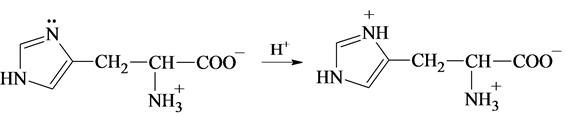




 Все природные α-аминокислоты, кроме глицина (NH2 CH2 COOH), имеют асимметрический атом углерода
Все природные α-аминокислоты, кроме глицина (NH2 CH2 COOH), имеют асимметрический атом углерода