
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 4. Классификация органических реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
По конечному результату: 1. Реакции присоединения 2. Реакции отщепления 3. Реакции замещения 4. Реакции изомеризации По механизму протекания: 1. Гетеролитические реакции 2. Гомолитические реакции
4.1.Классификация органических реакций по конечному результату: 1. Реакции присоединения
Присоединение галогенов (галогенирование) При действии на этиленовые углеводороды галогенов в результате присоединения их по месту двойной связи образуются дигалогенпроизводные предельных углеводородов с атомами галогена при соседних углеродных атомах. Например:
этилен СI Cl
1,2-дихлорэтан
BrBr
1,2-дибромпропан
2. Реакции отщепления (элиминирования) Действие спиртовых растворов едких щелочей на галогенпроизводные
Хлористый пропил пропилен
Отщепление воды от спиртов (реакция дегидратации) При действии на одноатомные спирты различных водоотнимающих средств происходит отщепление молекулы воды. При этом атом водорода отщепляется от углеродного атома, соседнего с тем, при котором находится гидроксильная группа спирта, что приводит к образованию непредельного углеводорода:
Н2SO4
этанол этилен
Водород отщепляется преимущественно от углерода, который содержит меньшее число атомов водорода, правило Зайцева. 1.Например: CH3—CH2—CH—CH3 СН3 —СН = СН- CH3 ОН бутен-2 бутанол-2
3.Реакции замещения Взаимодействие алканов с галогенами.
Взаимодействие насыщенных углеводородов с хлором или бромом ускоряется при нагревании и, особенно, при действии света. И атомы галогена постепенно замещают в углеродных молекулах атомы водорода. При этом образуются смеси галогенпроизводных углеводородов; реакция сопровождается выделением галогенводорода. Например: при действии хлора на метан происходит постепенное замещение всех атомов водорода и образуется смесь хлорпроизводных:
хлористый метил
дихлорметан
трихлорметан
тетрахлорметан(четыреххлористый углерод)
4. Реакции изомеризации
бутан CH3 изобутан 4.2.Классификация органических реакций по механизму протекания:
1. Гетеролитические (полярные и ионные) реакции Реакции нуклеофильного замещения у насыщенного атома углерода SN(S–substitution,замещение). N-нуклеофильное.
Например:
хлористый этил этанол
Реакции нуклеофильного присоединения по карбонильной группе Присоединение большинства реагентов по двойной связи С=О происходит как ионная реакция по механизму нуклеофильного присоединения AN (от англ. nucleophile addition). Присоединение циановодородной (синильной) кислоты HCN:
H CN Эта реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH-COOH
OH Например:
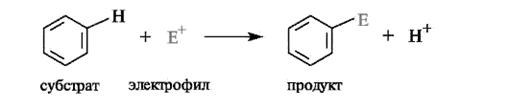
H CN уксусный альдегид циангидрин уксусного альдегида Электрофильные реакции. Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента. Электрофильные ("любящие электроны") реагенты или электрофилы - это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне. Электрофильноеприсоединение. Например:
Механизм реакции. Стадии:
2. CH2=CH2 + H+ 3. CH3- CH2 + + Cl-
I I пропилен Н Br 2-бромпропан Механизм электрофильного замещения в аренах обозначают - SE (S – substitution [замещение], E-электрофильное. Электрофильноезамещение в аренах: Механизма- SE 1.Галогенирование
2.Нитрование
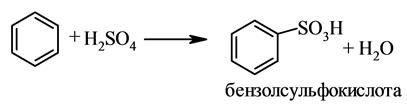
3.Сульфирование
4.Алкилирование
5.Ацилирование
Катион NO2+ образуется в смеси конц. кислот HNO3 и H2SO4.
Механизм реакции электрофильного замещения SE .
Реакции замещения протона в бензольном кольце на другие электрофилы можно представить следующим образом:
Где Е + – электрофил: Br +,NO2 +, SO3Н +, CH3 + СН3- С + = O Механизм реакции включает ряд общих стадий: Первичной стадией является образование электрофильной частицы Е. На второй стадии электрофильная частица, атакуя ароматическое кольцо, сначала образует нестойкий π-комплекс, в котором она одновременно связана со всеми π-электронами ароматической системы.
Третья стадия образование σ- комплекса(самая медленная стадия реакции). Электрофил «забирает» два электрона π-системы и образует σ-связь с одним из атомов углерода бензольного кольца. В σ-комплексе ароматичность нарушена, поскольку один из атомов углерода кольца перешел в sp3 -гибридизованное состояние. Некоторые σ-комплексы удалось выделить в индивидуальном виде. На последней (быстрой) стадии реакции происходит отщепление протона от σ-комплекса. Ароматическая система восстанавливается (недостающая до секстета пара электронов возвращается в бензольное ядро).Отщепляющийся протон связывается с нуклеофильной частью реагента У. Где Y – нуклеофил: Br-, OH-, CI -.
Электрофильные реакции присоединения
(R—NH2 + H+ R—NH3+)
II пропилен BrBr 1.2-дибромпропан
Механизм реакции.
I Br
BrBrBr
Б) Гомолитические (радикальные) реакции Механизм реакции.
По количеству молекул, участвующих в элементарной стадии, протекающей с наименьшей скоростью: Мономолеклярные, Бимолекулярные и т.д. Эти классы реакций неразрывно связаны между собой, ибо реакции присоединения могут протекать по электрофильному, нуклеофильному или радикальному механизмам, а реакции нуклеофильного замещения при насыщенном атоме углерода могут осуществляться посредством мономолекулярного, либо бимолекулярного механизма.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 1168; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.229.242 (0.011 с.) |

 R—CH=CH2 + Br2R—CHBr—CH2Br;
R—CH=CH2 + Br2R—CHBr—CH2Br; СН2 = СН2 + Cl2 CH2 — СН2
СН2 = СН2 + Cl2 CH2 — СН2 

 СН2=СН—СН3 + Br2CH2—CH—CH3
СН2=СН—СН3 + Br2CH2—CH—CH3
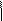 пропилен
пропилен R-CHBr-CH2-R' + KOH+С2Н5ОН R-CH = CH-R' +KBr +Н2О
R-CHBr-CH2-R' + KOH+С2Н5ОН R-CH = CH-R' +KBr +Н2О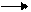 CH3-CH2-CH2-Cl +NaOH +C2H5OHСН3-СН =СН2+NaCl+Н2О
CH3-CH2-CH2-Cl +NaOH +C2H5OHСН3-СН =СН2+NaCl+Н2О СН3 – СН2 – ОН СН2 = CH2 + Н2О
СН3 – СН2 – ОН СН2 = CH2 + Н2О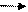 R-H + Cl2R-Cl + HCl
R-H + Cl2R-Cl + HCl СН4 + Сl 2свет СН3Cl + HCl
СН4 + Сl 2свет СН3Cl + HCl СН3Cl + Cl2свет CH2Cl2 + HCl
СН3Cl + Cl2свет CH2Cl2 + HCl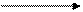 СНCl3 + Cl2свет CCl4 + HCl
СНCl3 + Cl2свет CCl4 + HCl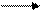 CH3 —CH2—CH2 — CH3 CH3—CH—CH3
CH3 —CH2—CH2 — CH3 CH3—CH—CH3
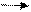 R— Cl+ NaOH R— OH + NaCl
R— Cl+ NaOH R— OH + NaCl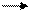 CH3—CH2—Cl СН3 – СН2 – ОН
CH3—CH2—Cl СН3 – СН2 – ОН R- С = O + H-CN R-CH-OH
R- С = O + H-CN R-CH-OH


 СН3- С = O + H-CN СН3-CH-OH
СН3- С = O + H-CN СН3-CH-OH

 CH3CH2Cl (электрофил - H + в составе HCl)
CH3CH2Cl (электрофил - H + в составе HCl)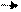 1. H-Cl H++ Cl-
1. H-Cl H++ Cl- СН2=СН—СН3 + НBr CH2—CH—CH3
СН2=СН—СН3 + НBr CH2—CH—CH3 




 СН2=СН—СН3 + Br2CH2—CH—CH3
СН2=СН—СН3 + Br2CH2—CH—CH3 1. Br2 Br+ + Br -
1. Br2 Br+ + Br - 2.СН2=СН—СН3 + Br+ СН2— +СН—СН3
2.СН2=СН—СН3 + Br+ СН2— +СН—СН3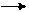 3.СН2—+СН—СН3 + Br- CH2—CH—CH3
3.СН2—+СН—СН3 + Br- CH2—CH—CH3 II
II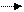 1.Сl: Cl + hn2Cl .
1.Сl: Cl + hn2Cl .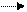 2.CH4 + Cl . CH3 + HCl
2.CH4 + Cl . CH3 + HCl 3.CH3 + Cl2CH3Cl + Cl .
3.CH3 + Cl2CH3Cl + Cl .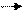 4. Cl . +CH3CH3Cl
4. Cl . +CH3CH3Cl


