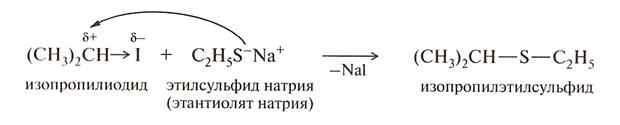Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотность и основность по ЛьюисуСодержание книги
Поиск на нашем сайте По Льюису, кислотные и основные свойства органических соединений оцениваются по способности принимать или предоставлять электронную пару с последующим образованием связи. Атом, принимающий электронную пару, является акцептором электронов, а соединение, содержащее такой атом, следует отнести к кислотам. Атом, предоставляющий электронную пару, является донором электронов, а соединение, содержащее такой атом - основание. Например: к кислотам Льюиса относятся BF3, ZnCl2, AlCl3, FeCl3, FeBr3, TiCl4, SnCl, SbCl5, катионы металлов, серный ангидрид – SO3, карбкатион. К основаниям Льюиса относятся амины RNH2, R2NH, R3N, спирты ROH, простые эфиры ROR, тиолы RSH, тиоэфиры RSR, анионы, соединения, содержащие π-связи (в том числе ароматические и гетероциклические соединения.
5.3.Концепция жестких и мягких кислот и оснований (принцип ЖМКО, принцип Пирсона) Общий подход деления кислот и оснований на жесткие и мягкие может быть охарактеризован следующим образом. Жесткие кислоты - кислоты Льюиса, в которых акцепторные атомы малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Молекулярная орбиталь жестких кислот, на которую переходят электроны донора, имеет низкий уровень энергии. Мягкие кислоты - кислоты Льюиса, содержащие акцепторные атомы большого размера с малым положительным зарядом, с небольшой электроотрицательностью и высокой поляризуемостью. Молекулярная орбиталь мягких кислот, принимающая электроны донора, имеет высокий уровень энергии. Жесткие основания - донорные частицы, в которых атомы-доноры имеют высокую электроотрицательность и низкую поляризуемость. Валентные электроны удерживаются прочно, продукт окисляется с трудом. Орбиталь, пара электронов которой передается акцептору, имеет низкий уровень энергии. Донорными атомами в жестких основаниях могут быть кислород, азот, фтор, хлор. Мягкие основания - донорные частицы, в которых атомы-доноры имеют низкую электроотрицательность и высокую поляризуемость, они легко окисляются; валентные электроны удерживаются слабо. Орбиталь, пара электронов которой передается акцептору, обладает высоким уровнем энергии. Донорными атомами в мягких основаниях выступают атомы углерода, серы, иода. Табл.4
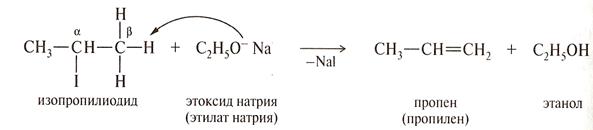
В соответствии с принципом жестких и мягких кислот и оснований (ЖМКО) Пирсона кислоты Льюиса делятся на жесткие и мягкие. Жесткие кислоты- акцепторные атомы с малым размером, большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Мягкие кислоты- акцепторные атомы большого размера с малым положительным зарядом, с небольшой электроотрицательностью и высокой поляризуемостью. Суть ЖКМО состоит в том, что жесткие кислоты реагируют с жесткими основаниями и мягкие кислоты реагируют с мягкими основаниями. Например: при взаимодействии этилата натрия с изопропилйодидом, этоксид - ион С2Н5О- как жёсткое основание будет реагировать с жёсткой кислотой, какой является протон в - положении. Преобладающей будет реакция отщепления. При действии этантиолятом натрия этилсульфид – ион С2Н5S -, являясь мягким основанием,будет атаковать тетраидрический атом углерода как более мягкую кислоту. Основная реакция – замещение йодид-иона.
Изогнутой стрелкой показано направление атаки реагента.
|
||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 1597; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.009 с.) |

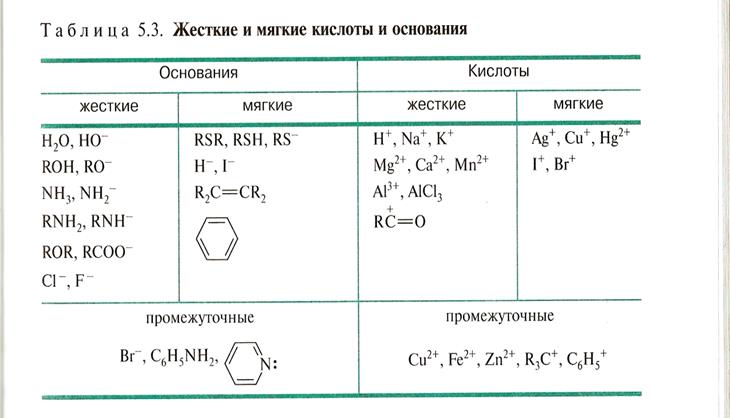 ЖМКО
ЖМКО