
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Таутомерия глюкозы и что такое мутаротацияСодержание книги
Поиск на нашем сайте
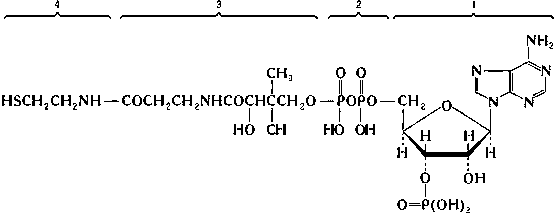
В природе встречается только D-глюкоза, к-рая выделена в виде двух аномеров: При восстановлении D-глюкозы обр-ется сорбит, при окислении альдегидной группы - D-глюконовая к-та, при окислении последней-двухосновная сахарная к-та (дополнительно окисляется первичная гидроксигруппа), при окислении только первичной гидроксигруппы (при защите альдегидной)-D-глюкуроновая к-та. Осн. пути метаболизма D-глюкозы: 1) гликолиз и аэробное окисление до СО2 и Н2О, в результате к-рых обр-ются АТФ и др. макроэргич. соединения; 2) синтез олиго- и полисахаридов; 3) превращение в пентозы и др. простые сахара в пентозофосфатном цикле. О биосинтезе D-глюкозы см. Глюконеогенез. КоА кофермент А КоА, кофермент ацетилирования (или ацилирования), важнейший из коферментов, принимающий участие в реакциях переноса ацильных групп. Молекула КоА состоит из остатка адениловой кислоты (1), связанной пирофосфатной группой (2) с остатком пантотеновой кислоты (3), которая, в свою очередь, соединена пептидной связью с остатком β-меркаптоэтаноламина (4); С КоА связан обширный круг биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза липидов, окислительных превращений продуктов распада углеводов и т. д. Во всех случаях КоА действует как промежуточное соединение, связывающее (акцептирующее) и переносящее кислотные остатки на др. вещества. При этом кислотные остатки либо подвергаются в составе соединения с КоА тем или иным превращениям, либо передаются без изменений на определённые метаболиты. «Активную» форму органических кислот представляют ацильные остатки, присоединённые к сульфгидрильной (SH) группе КоА макроэргической ацилтиоэфирной связью. Пантотеновая к-та в виде КоА участвует в УГном и жировом обмене, в синтезе ацетилхолина, в коре надпочечников стимулирует обр-ние кортикостероидов. Биосинтез пантотеновой к-ты осуществляется из пантоевой к-ты (она синтезируется из 2-оксоизовалериановой к-ты) и р-аланина. Катаболизм KoA у высших жив на первых стадиях осущ-ся неспецифич деацилазами и фосфа-тазами до 4'-фосфопантетеина или пантетеина. Пантетиназа, активность к-рой особенно высока в почечной ткани, гидро-лизует эти катаболиты до 4'-фосфопантотеновой к-ты, пантотеновой к-ты и цистеамина H2NCH2CH2SH, явл-ся конечными прод в катаболизме KoA у жив. Большинство микроорг-мов явл пантотенатпро-тотрофными, т. е. осуществляют биосинтез пантотеновой к-ты. Ее катаболизм у микроорг-мов начинается с гидролиза вит-а до D-пантоевой к-ты и Пром. получение пантотеновой к-ты в форме ее солей осуществляют через D-пантолактон или D-пантамид. Рилизинг-факторы (либерины) Установлено, что по хим стр все гормоны гипоталамуса явл низкомол-лярными пептидами, так наз олигопептидами необычного стр-ия, хотя точный АМКный состав и первич стр-ра выяснены не для всех. 1. Тиролиберин (Пиро-Глу–Гис–Про–NH2): представлен трипептидом, состоящим из пироглутаминовой (циклической) к-ты, гистидина и пролинамида, соединенных пептидными связями. В отличие от классических пептидов он не содержит свободных NH2- и СООН-групп у N- и С-концевых АМК. 2. Гонадолиберин явл декапептидом, состоящим из 10 АМК в послед-сти: Пиро-Глу–Гис–Трп–Сер–Тир–Гли–Лей–Арг–Про–Гли-NН2 Концевая С-АМКа представлена глицинамидом. 3. Соматостатин явл циклическим тетрадекапептидом (состоит из 14 АМКных остатков). Отличается этот гормон тем, что не содержит на N-конце пироглутаминовой к-ты: дисульфидная связь обр-ется м/у двумя остатками цистеина в 3-м и 14-м положениях. Следует отметить, что синтетический линейный аналог соматостатина также наделен аналогичной биологической активностью, что свидетельствует о несущественности дисульфидного мостика природного гормона. Помимо гипоталамуса, соматостатин продуцируется нейронами центральной и периферической нервных систем, а также синтезируется в S-клетках панкреатических островков (островков Лангерганса) в поджелудочной железе и клетках кишечника. Он оказывает широкий спектр биологического действия; в частности, показано ингибирующее действие на синтез гормона роста в аденогипофизе, а также прямое тормозящее действие его на биосинтез инсулина и глюкагона в β- и α-клетках островков Лангерганса. 4. Соматолиберин недавно выделен из природных источников. Он представлен 44 АМКными остатками с полностью раскрытой послед стью. Биологической активностью соматолиберина наделен, кроме того, химически синтезированный декапептид. Этот декапептид стимулирует синтез и секрецию гормона роста гипофиза соматотропина. 5. Меланолиберин, химическая стр-ра к-рого аналогична стр-ре открытого кольца гормона окситоцина (без трипептидной боковой цепи), имеет следующее строение: 6. Меланостатин (меланотропинингибирующий фактор) представлен или трипептидом: Пиро-Глу–Лей–Гли-NН2, или пентапептидом со следующей послед стью. Необходимо отметить, что меланолиберин оказывает стимулирующее действие, а меланостатин, напротив, ингибирующее действие на синтез и секрецию меланотропина в передней доле гипофиза. Помимо перечисленных гипоталамических гормонов, интенсивно изучалась химическая природа другого гормона – кортиколиберина. Активные препараты его были выделены как из ткани гипоталамуса, так и из задней доли гипофиза; существует мнение, что последняя может служить депо гормона для вазопрессина и окситоцина. Недавно выделен состоящий из 41 АМКы с выясненной послед стью кортиколиберин из гипоталамуса овцы. Местом синтеза гипоталамических гормонов, вероятнее всего, явл нервные окончания – синаптосомы гипоталамуса, поскольку именно там отмечена наибольшая конц-ция гормонов и биогенных аминов. Последние рассматриваются наряду с гормонами периферических желез внутренней секреции, действующих по принципу обратной связи, в качестве основных регуляторов секреции и синтеза гормонов гипоталамуса. Механизм биосинтеза тиролиберина, осуществляющегося, скорее всего, нерибо-собальным путем, включает участие SH-содержащей синтетазы или комплекса ф-тов, кат-ющих циклизацию глутаминовой к-ты в пироглутаминовую, обр-ние пептидной связи и амидирование проли-на в присутствии глутамина. Существование подобного механизма биосинтеза с участием соотв-ующих синтетаз допускается также в отношении гонадолиберина и соматолиберина. Гипоталамические гормоны непосредственно влияют на секрецию (точнее, освобождение) «готовых» гормонов и биосинтез этих гормонов de novo. Доказано, что цАМФ участвует в передаче гормонального сигнала. Показано существование в плазматических мембранах клеток гипофиза специфических аденогипофизарных рецепторов, с к-рыми связываются гормоны гипоталамуса, после чего через систему аденилатциклазы и мембранных комплексов Са2+–АТФ и Mg2+–АТФ освобождаются ионы Са2+ и цАМФ; последний действует как на освобождение, так и на синтез соотв-ующего гормона гипофиза путем активирования протеинкиназы. Билет №11
|
||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 442; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.124.28 (0.01 с.) |

 и
и 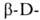 глюкопиранозы (соотв. ф-лы I и II). Первая кристаллизуется из воды в виде моногидрата с т. пл. 83°С; для безводной формы т. пл. 146°С,
глюкопиранозы (соотв. ф-лы I и II). Первая кристаллизуется из воды в виде моногидрата с т. пл. 83°С; для безводной формы т. пл. 146°С, 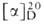 + 112,2° (вода).
+ 112,2° (вода). 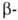 Аномер кристаллизуется из пиридина или нек-рых др. р-рителей; его т. пл. 148-150°С,
Аномер кристаллизуется из пиридина или нек-рых др. р-рителей; его т. пл. 148-150°С, 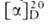 +18,9° (вода). В водном р-ре устанавливается динамич. равновесие м/у неск. таутомерами:
+18,9° (вода). В водном р-ре устанавливается динамич. равновесие м/у неск. таутомерами: 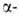 и
и  формами D-глюкофуранозы (ф-лы соотв. III и IV) и D-глюкопиранозы, открытой альдегидной (V) и ее гидратной формой (VI). Содержание
формами D-глюкофуранозы (ф-лы соотв. III и IV) и D-глюкопиранозы, открытой альдегидной (V) и ее гидратной формой (VI). Содержание 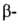 и
и  глюкопираноз составляет соотв. ок. 64 и 36%, др. таутомеров - менее 1%. Равновесное
глюкопираноз составляет соотв. ок. 64 и 36%, др. таутомеров - менее 1%. Равновесное 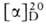 +52,7°. Самый устойчивый таутомер-
+52,7°. Самый устойчивый таутомер-  -глюкопираноза в конформации кресла (ф-ла VII).
-глюкопираноза в конформации кресла (ф-ла VII).
 -аланина; D-пантоевая к-та в последовательных р-циях превращ. в D-4-оксопантоевую, D-3,3-диметиляблочную и далее в 2-оксоизовалериановую к-ту.
-аланина; D-пантоевая к-та в последовательных р-циях превращ. в D-4-оксопантоевую, D-3,3-диметиляблочную и далее в 2-оксоизовалериановую к-ту.


