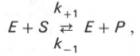Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Цикл глюкоза в лактат и сколько нужно и затрачено атфСодержание книги
Поиск на нашем сайте
Гликолиз – это послед-сть фер-тативных р-ций, приводящих к превращению глюкозы в пируват с одновременным обр-нием АТФ. При аэробных усл пируват проникает в митох, где полностью окис-ся до СО2 и Н2О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце, пируват превращается в лактат. Итак, гликолиз – не только главный путь утилизации глюкозы в клетках, но и уникальный путь, поскольку он может использовать кислород, если последний доступен (аэробные условия), но может протекать и в отсутствие кислорода (анаэробные условия). Анаэробный гликолиз (АГ) – сложный ф-тативный процесс распада глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза явл молочная к-та. В проц.гликолиза обр-ется АТФ. Суммарное ур-ние гликолиза можно представить след образом:
В анаэроб усл гликолиз – единственный проц в жив-ом орг-ме, поставляющий энергию. Именно благодаря гликолизу орг-м ч-ка и жив определенный период может осущ-ть ряд физиологич ф-ций в усл недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе. · Первой ф-тативной р-цией Гл явл фосфорили-рование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Р-ция катализируется ф-том гексокиназой:
Наиболее важным св-вом гексокиназы явл ее ингибирование глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктом р-ции, и аллостерическим ингибитором. Ф-т гексокиназа способен катал-вать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и т.д. В печени, кроме гексокиназы, сущ-ет ф-т глюкокиназа, к-рый катал-ет фосфорилирование только D-глюкозы. В мышечной ткани этот ф-т отсутствует. · Второй р-цией гликолиза явл превращение глюкозо-6-фос-фата под действием ф-та глюкозо-6-фосфат-изомеразы во фруктозо-6-фосфат:
Эта р-ция протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов. · Третья р-ция катализируется ф-том фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй мол-лы АТФ:
Данная р-ция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и явл наиболее медленно текущей р-цией гликолиза. Фактически эта р-ция определяет скорость гликолиза в целом. Фосфофруктокиназа относится к числу аллостерических ф-тов. Она ингибируется АТФ и стимулируется АМФ. При значительных величинах отнош АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а конц-ция АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза. · Четвертую р-цию гликолиза катализирует ф-т альдолаза. Под влиянием этого ф-та фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
Эта р-ция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры р-ция сдвигается в сторону большего обр-ния триозофосфатов (дигидро-ксиацетонфосфата и глицеральдегид-3-фосфата). · Пятая р-ция – это р-ция изомеризации триозофосфатов. Катализируется ф-том триозофосфатизомеразой:
Равновесие данной изомеразной р-ции сдвинуто в сторону дигидроксиацетонфосфата: его 95% и около 5% глице-ральдегид-3-фосфата. В последующие р-ции гликолиза может непосредственно включаться только один из двух обр-щихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы ди-гидроксиацетонфосфат превращается в глицеральдегид-3-фосфат. Обр-нием глицеральдегид-3-фосфата как бы завершается 1-ая стадия гликолиза. 2-ая стадия – наиб сложная и важная. Она включает окислительно-восстановительную р-цию (р-ция гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе к-рого обр-ется АТФ. · В результате шестой р-ции глицеральдегид-3-фосфат в присутствии ф-та глицеральдегидфосфатдегидрогеназы, коф-та НАД и неорганического фосфата подвергается своеобразному окислению с обр-нием 1,3-бисфосфоглицериновой к-ты и восстановленной формы НАД (НАДН). Эта р-ция блокируется йод- или бромацетатом, протекает в несколько этапов:
1,3-Бисфосфоглицерат представляет собой высокоэнергетическое соединение. Механизм действия глицеральдегидфосфатдегидрогеназы сводится к след: в присутствии неорг-ого фосфата НАД+ выступ как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе обр-ния НАДН глицеральдегид-3-фосфат связ-тся с мол-лой ф-та за счет SH-групп последнего. Обр-шаяся связь богата энергией, но она непрочная и расщ-тся под влиянием неорг-ого фосфата, при этом обр-ется 1,3-бисфосфоглицериновая к-та. · Седьмая р-ция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с обр-нием АТФ и 3-фосфогли-цериновой к-ты (3-фосфоглицерат):
Т.об., благодаря действию двух ф-тов (глицеральде-гидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительного фосфорилирования обр-ние АТФ из высокоэнергетических соединений называется субстратным фосфорилированием. · Восьмая р-ция сопровож-ся внутримол-лярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая к-та превращ в 2-фосфоглицериновую к-ту (2-фосфоглицерат). Р-ция легко обратима, протекает в присутствии ионов Mg2+. Кофактором ф-та явл также 2,3-бисфосфоглицериновая к-та аналогично тому, как в фосфоглюкомутазной р-ции роль кофактора выполняет глюкозо-1,6-бисфосфат:
· Девятая р-ция катализируется ф-том енолазой, при этом 2-фосфоглицериновая к-та в результате отщепления мол-лы воды переходит в фосфоенолпировиноградную к-ту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической:
Енолаза активируется двухвалентными катионами Mg2+или Мn2+ и ингибируется фторидом. · Десятая р-ция хар-ризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование). Катализируется ф-том пируваткиназой:
Для действия пируваткиназы необходимы ионы Mg2+, а также одновалентные катионы щелочных металлов (К+ или др.). Внутри клетки р-ция явл практически необратимой. · В результате одиннадцатой р-ции происходит восстановление пировиноградной к-ты и обр-ется молочная к-та. Р-ция протекает при участии ф-та лактатдегидрогеназы и коф-та НАДН, образовавшегося в шестой р-ции:
Билет №5 МРНК строение и роль Структура и свойства мРНК. Стр мРНК, как и соответ кодируемых ими белков, обладает высокой специф-стью. Мол-рные размеры мРНК сильно варьируют -от сотен основ до неск сотен тыс осн. Третич стр-ры мРНК индивид-ны, хар-ются разнообр и высоким содержанием биспиральных шпилек и петель. Осн назнач мРНК – переписывание ген инф-ции о первич стр-ре кодируемых белков с ДНК и участие в качестве матрицы в рибосомальном биосинтезе белков и пептидов. Есть принципиальные отличия в строении мРНК прокариотов и эукариотов. Главным образом они заключаются в том, что эукариотическая мРНК моноцистронная, а прокариотическая мРНК полицистронная. Кроме этого в мРНК велика доля некодирующих участков, которые выполняют вспомогательные функции в реакциях созревания и деградации мРНК, взаимодействия с рибосомой, в процессе биосинтеза белка - 7-метил-гуанозиновый “кэп” на 5’-конце мРНК, своеобразный хвост поли-(А) размером 50-400 оснований на 3’-конце мРНК. К ним можно добавить инициирующий кодон АУГ и терминирующие кодоны УГА или УАА. Принципиально отличаются и молекулярные механизмы формирования зрелых молекул мРНК. Дело в том, что в отличие от прокариотов гены эукариотов мозаичны, т.е. содержат кодирующие (экзоны) и некодирующие (интроны) участки. В связи с этим, в ЭКК функц-ет спец биохим мех-м, к-рый распознает некодирующие участки в первичном продукте транскрипции гена, чрезвычайно точно вырезает такие некодирующие участки, а кодирующие последовательности сшивает в единый линейный полинуклеотид – зрелую мРНК. В исключительных случаях РНК может использоваться, как форма хранения генетического материала. Это явление характерно для РНК-содержащих вирусов. План и программа развития таких вирусов включает функционирование специального фермента -обратной транскриптазы, которая синтезирует ДНК на матрице РНК. Обратная транскриптаза используется для синтеза кодирующей ДНК (кДНК) на основе мРНК, т.е. по существу позволяет синтезировать гены, фрагменты генов для последующего конструирования рекомбинантных ДНК или секвенирования.
Крахмал – основной запасной гомогликан (D-глюкан) растений, откладывающийся внутри клеток в виде специальных зерен. Крахмал представляет собой смесь двух других гомогликанов линейной амилозы (10-30%) и разветвленного амилопектина (70-90%). Амилоза построена из остатков a-D-глюкопиранозы, соединенных a(1 ® 4)-связями. Амилопектин состоит из остатков a-D-глюкопиранозы, соединенных a(1 ® 4)-связями в линейных участках, а также a(1 ® 6)-связями в точках ветвления, которые встречаются в среднем через каждые 20-30 остатков моносахарида. Молекулярная масса крахмала около 105-107. Содержание крахмала в клубнях картофеля достигает 25%, а в зернах злаковых до 80%. Крахмал гидролизуется a-амилазами вплоть до свободной a-D-глюкозы. Гликоген – гомогликан (D-глюкан), весьма сходный по строению с амилопектином. Для гликогена характерна более высокая степень ветвления и более компактная структура. Гликоген состоит из остатков a-D-глюкопиранозы, соединенных a(1 ® 4)-связями в линейных участках, а также a(1 ® 6)-связями в точках ветвления. Молекулярная масса гликогена около 105-108. Содержание гликогена в мышцах до 4%, а в печени до 10%. Гликоген гидролизуется в реакциях амилолиза и фосфоролиза вплоть до свободной a-D-глюкозы или ее фосфорного эфира. Исключительное значение этих реакций нашло отражение в присуждении Нобелевской премии в 1947 году Кори К.Ф. и Кори Г.Т. (США). Гликоген – это главный тканевый резерв углеводов у животных и человека. Встречается в грибах, в микроорганизмах, в некоторых растениях. Декстрины представляют собой продукты частичного ферментативного гидролиза гликогена и крахмала в организме. Декстраны – это группа микробных резервных полисахаридов. Состоят из остатков a-D-глюкопиранозы, соединенных a(1®6)-связями в линейных участках, а также a(1®2)-, a(1®3)- и a(1®4)-связями в точках ветвления. Молекулярная масса достигает величин порядка 108. Природные декстраны подвергают ограниченному гидролизу до молекулярной массы 10000-50000 с образованием так называемых клинических декстранов, которые используются в качестве кровезаменителей.
Целлюлоза (клетчатка) – линейный полимер D-глюкопиранозы с b(1®4)-связями и молекулярной массой около 105-108. Целлю-лоза практически нерастворима в воде, составляет около 50% древесины и более 95% хлопка. Поскольку целлюлоза состав-ляет около половины всех ор-ганических соединений на Земле, биосинтез целлюлозы - это основное направление использования солнечной энергии в биосфере. Целлюлоза не гидролизуется ферментами пищеварительных соков человека, а частичное расщепление целлюлозы (около 10%) в ЖКТ реализуется при уч ферментов микроорг целлюлаз. Мол-лы целлюлозы, вступая в сложные взаимодействия между собой и с другими биополимерами (лигнины, гемицеллюлозы, пектиновые вещества и др.), формируют легкий и прочный, плотный или ажурный фитокаркас и в конечном итоге создают все богатство форм мира растений. Гемицеллюлозы – группа гомогликанов, которые вместе с целлюлозой, лигнинами, пектиновыми веществами формируют матрикс оболочки клеток растений, особенно в одревесневших частях растений. Гидролизуются специальными ферментами гемицеллюлазами.
Арахидоновая кисл и её произв(ПГ)
Например, ПГF2α - это простагландин серии F, производное арахидоновой кислоты с двумя двойными связями и с ориентацией ОН-группы при С-9 углеродной цепи за плоскость циклопентанового кольца. В структуре простагландинов и других эйкозаноидов есть хиральные С-атомы, конфигурация которых определяет особую конформацию молекул, стереоспецифичность их биосинтеза и биологической активности. Биосинтез простагландинов осуществляется во многих клетках (особенно в репродуктивных клетках, в нейронах, тромбоцитах, миокарде, матке, в эндокринных клетках и др.) по единому циклооксигеназному пути. Ключевой фермент этого пути простагландин-синтетаза с использованием О2 осуществляет циклизацию полиеновых кислот, форм-ние циклопентанового кольца и образование эндопероксидов – первоначальных простагландинов ПГG и ПГН. Ацетилсалициловая к-та и индометацин явл специфич ингибиторами простагландин-синтетазы, что лежит в основе их лечебного действия – противовоспалительного, обезболивающего, кардиопротекторного и др. Дальнейшие ферментативные преобразования ПГG и ПГН приводят к появлению всех других простагландинов, а также тромбоксанов и простациклинов. Простагландины быстро метаболизируются (t1/2 не более 30 секунд), легко окисляются и не накапливаются в тканях и жидкостях организма. Простагландины действуют не только локально вблизи места синтеза, но и дистантно за счет перемещения по кровеносной системе. Биологическая активность простагландинов проявляется уже в концентрациях 10-10 - 10-12 М, а суточный биосинтез простагландинов у человека не превышает 5 мг! Чрезвычайно индивидуальны и разнообразны биохимические свойства и физиологическая гормоноподобная активность простагландинов. Ряд простагландинов обладает сходными эффектами – регулируют гомеостаз, вызывают повышение температуры тела, оказывают седативное и транквилизирующее действие, усиливают секрецию поджелудочного сока, но ослабляют секрецию соляной кислоты и пепсина желудком, увеличивают моторику кишечника, модулируют синаптическую передачу нервных импульсов, усиливают проявление воспалительных и болевых реакций. Ряд функций характерен исключительно для определенных простагландинов: ПГЕ2 стимулирует роды; ПГЕ сокращают, а ПГF расслабляют гладкие мышцы сосудов и дыхательных путей; ПГD и ПГJ обладают противораковой и противовирусной активностью и т.п. Биохимические ответы клеток-мишеней реализуются при участии специфических белковых рецепторов простагландинов и внутриклеточных вторичных мессенджеров. Простагландины и некоторые другие эйкозаноиды встречаются не только у позвоночных животных и человека, но и у очень многих одноклеточных и многоклеточных организмов различных таксонов. Особенно богаты простагландинами гидробионты – кораллы, морские ежи, моллюски. Арахидоновая кислота — бесцветная маслянистая жидкость, легко окисляется кислородом воздуха.
Арахидоновая кислота - полиненасыщенная жирная кислота, входит в состав мембранных фосфолипидов тромбоцитов и эндотелиальных клеток. Высвобождается из фосфолипидов под действием фосфолипазы А2 и фосфолипазы С,активируемых коллагеном, тромбином, АДФ и другими биологически активными веществами. Арахидоновая кислота является предшественником в синтезе оксилипинов.Свободная арахидоновая кислота быстро метаболизируется, превращаясь в высокоактивные соединения - простагландины и тромбоксаны.
Арахидоновой кислоте приписывается важная роль в регуляции лиганд-рецепторных взаимодействий, активности ионных каналов и активности регуляторных ферментов (гуанилатциклазы, протеинкиназы C) в качестве внутриклеточного мессенджера. Возможно, что, по крайней мере, некоторые из перечисленных проявлений активности арахидоновой кислоты опосредуются через взаимодействие с клеточными связывающими жирные кислоты белками. Существует два основных пути метаболизма арахидоновой кислоты - циклоксигеназный и липоксигеназный. Циклоксигеназный путь метаболизма арахидоновой кислоты приводит к образованию простагландинов и тромбоксана A2, липоксигеназный - к образованию лейкотриенов. В тучных клетках легких синтезируются как простагландины, так и лейкотриены, в базофилах - только лейкотриены. Основной фермент липоксигеназного пути метаболизма арахидоновой кислоты в базофилах и тучных клетках - 5-липоксигеназа. 12-липоксигеназа и 15-липоксигеназа играют меньшую роль. Однако образующиеся в незначительном количестве 12-гидропероксиэйкозотетраеновая кислота и 15-гидропероксиэйкозотетраеновая кислота играют важную роль в воспалении.
ИЗОМЕРАЗЫ, класс ферментов, катализирующих р-ции изомеризации. П/клсы изомераз (их 5) сформ-ваны по типам р-ций, а подп/клсы по типам субстратов. Рацемазы и эпимеразы кат-ют соотв. рацемизацию и эпимеризацию в-в. Субстраты рацемаз содержат один хиральный центр, эпимераз несколько. У исследованных рацемаз -АМК кофермент пиридоксальфосфат. 5.как влияет концентрац......(константа мих-мэнтоса) Одним из наиболее сущ-нных факторов, определяющих скорость фер-вной р-ции, явл конц-ция субстрата (или субстратов) и продукта (продуктов). При пост конц-ции фермента скор реакции постепенно увелич, достигая определ максимума, когда дальнейшее увеличение кол-ва субстрата практически не оказывает влияния на скор ферм-вной р-ции. В таких случ принято считать, что субстрат находится в избытке, а фермент полностью насыщен, т.е. все молекулы фермента связаны с субстратом. Ограничивающим скорость реакции фактором в последнем случае становится концентрация фермента. Именно при этих условиях определяют величину максимальной скорости (Vmax) и значения константы Михаэлиса (Km). Скорость любой ферментативной реакции непосредственно зависит от концентрации фермента. Существующая линейная зависимость между этими величинами, когда скорость реакции прямо пропорциональна количеству присутствующего фермента, справедлива только в определенных условиях, например в начальный период ферментативной реакции, так как в этот период практически не происходит обратной реакции, а концентрация продукта оказывается недостаточной для обратимости реакции. Именно в этом случае скорость реакции (точнее, начальная скорость реакции v) будет пропорциональна концентрации фермента. Как было отмечено, фермент является одной из реагирующих молекул в химической реакции и при взаимодействии с субстратом образует промежуточный фермент-субстратный комплекс, который далее подвергается распаду на продукт и свободный фермент:
то в уравнениях для скоростей прямой и обратной реакций обязательным компонентом является концентрация фермента:
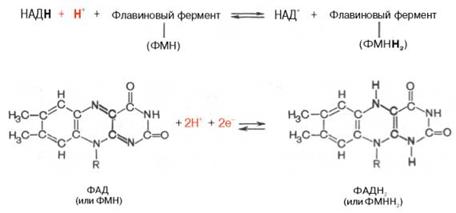
Тканевое дыхание и биологическое окисление. Распад органических соединений в живых тканях, сопровождающийся потреблением молекулярного кислорода и приводящий к выделению углекислого газа и воды и обр-нию биологических видов энергии, наз тканевым дыханием. Тканевое дыхание представляют как конечный этап пути превращений моносахаров (в основном глюкозы) до указанных конечных продуктов, в к-ый на разных стадиях включаются другие сахара и их производные, а также промежуточные продукты распада липидов (ЖК), белков (АМКы) и нуклеиновых оснований. Итоговая реакция тканевого дыхания будет выглядеть следующим образом: С6Н12О6 + 6O2 = 6СO2+ 6Н2O + 2780 кДж/моль. (1) Использование клетками кислорода открывает возможности для более полного окисления субстратов. В аэробных условиях продукты бескислородного окисления становятся субстратами цикла трикарбоновых кислот, в ходе которого образуются восстановленные дыхательные переносчики НАДФН, НАДН и флавиновые коферменты. Способность НАД+ и НАДФ+ играть роль промежуточного переносчика водорода связана с наличием в их структуре амида никотиновой кислоты. При взаимодействии этих кофакторов с атомами водорода имеет место обратимое гидрирование (присоединение атомов водорода):
При этом в молекулу НАД+ (НАДФ+) включаются 2 электрона и один протон, а второй протон остается в среде. Во флавиновых коферментах (ФАД или ФМН), активной частью молекул которых является изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюдается присоединение 2 протонов и 2 электронов одновременно:
Восстановленные формы этих кофакторов способны транспортировать водород и электроны к дых цепи митохондрий или иных энерго-сопрягающих мембран. Организация и функционирование дыхательной цепи. В ЭКК дых цепь располож во внутр мембране митох, у дышащих бактерий – в цитоплазматической мембране и специализированных структурах – мезосомах, или тилакоидах. Молярные соотнош компонентов дых цепи явл пост, ее компоненты встроены в митохондр мембрану в виде 4 белково-липидных комплексов: НАДН-КоQН2-редуктаза (комплекс I), сукцинат-КоQ-редуктаза (комплекс II), КоQН2-цитохром c-редуктаза (комплекс III) и цитохром а-цитохромокси-даза (комплекс IV). Если субстратом окисления служат α-кетокислоты, в переносе электронов на НАД+ участвуют липоатсодержащие дегидрогеназы. В случае окисления пролина, глутамата, изоцитрата и других субстратов перенос электронов происходит непосредственно на НАД+. Восстановленный НАД в дыхательной цепи окисляется НАДН-дегидрогеназой, содержащей железосерный белок (FeS) и ФМН и прочно связанной с дыхательной цепью. KoQ (убихинон), - служит коллектором восстановительных эквивалентов, поставляемых в дых цепь через флавиновые дегидрогеназы. Содержание его значит превосходит содержание других компонентов дыхательной цепи. Дополнительным участником дых цепи явл FeS. Он участвует в окислительно-восстановительном процессе, протекающем по одноэлектронному типу. Первый участок локализации FeS находится между ФМН и KoQ, второй - между цитохромами b и c1. Это соотв тому факту, что со стадии ФМН путь протонов и электронов разделяется: первые накапливаются в митохондриальном матриксе, а вторые идут на гидрофобные переносчики - KoQ и цитохромы. Цитохромы в дых цепи выстроены в порядке возрастания окислит-восст-льного потенциала. Они предст собой гемопротеины, в которых простетическая геминовая группа близка к гему гемоглобина (у цитохрома b идентична). Ионы железа в сост гема при получении и отдаче электронов обратимо изменяют свою валентность. В процессах тканевого дыхания наиболее важную роль играют цитохро-мы b, с1, с, а и а3. Цитохром а3 представляет собой терминальный участок дыхательной цепи – цитохромоксидазу, которая осуществляет окисление цитохрома с и образование воды. Элементарный акт представляет собой двухэлектронное восстановление одного атома кислорода, т.е. каждая молекула кислорода одновременно взаимодействует с двумя электрон-транспортными цепями. При транспорте каждой пары электронов во внутримитохондриальном пространстве может накапливаться до 6 протонов. Окислительное фосфорилирование и дыхательный контроль. Функция дых цепи – утилизация восст-ных дых переносчиков, обр-щихся в р-циях метаболич окисления субстратов (гл.об. в ЦТК). Каждая окислительная реакция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соответственно своим окисл-но-восст-ным потенциалам эти соединения в восстановленной форме подключаются к дыхательной цепи. В дыхательной цепи происходит дискриминация протонов и электронов: в то время как протоны переносятся через мембрану, создавая ΔрН, электроны движутся по цепи переносчиков от убихинола к цитохромоксидазе, генерируя разность электрических потенциалов, необходимую для обр-ния АТФ протонной АТФ-синтазой. Т.об., тканевое дыхание «заряжает» митохондр мембрану, а окислит фосфорилирование «разряжает» ее. Обычно в тканях восстановленный НАДФ используется в пластическом обмене, обеспечивая разнообразные синтетические процессы, так что равновесие трансгидрогеназной реакции сильно сдвинуто влево. Эффективность окислительного фосфорилирования в митохондриях определяется как отношение величины образовавшегося АТФ к поглощенному кислороду: АТФ/О или Р/О (коэффициент фосфорилирования). Экспериментально определяемые значения Р/О, как правило, оказываются меньше 3. Это свидетельствует о том, что процесс дыхания не полностью сопряжен с фосфорилированием. Действительно, окислительное фосфорилирование в отличие от субстратного не является процессом, в котором окисление жестко сопряжено с образованием макроэргов. Степень сопряжения зависит главным образом от целостности митохондриальной мембраны, сберегающей разность потенциалов, создаваемую транспортом электронов. По этой причине соединения, обеспечивающие протонную проводимость (как 2,4-ди-нитрофенол), являются разобщителями. Билет 6
|
||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 334; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.89.89 (0.014 с.) |


 Обр-ние глюкозо-6-фосфата в гексокиназной р-ции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Обр-ние глюкозо-6-фосфата в гексокиназной р-ции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.











 Простагландины (ПГ, PG) – это биологически активные С20-производные гипотетической простановой кислоты. Все многооб-разие типов природных простагландинов зависит от строения и положения кислород-содержащих заместителей: типы простагландинов - А, B, C, D, E, F, G, H, I, J. Чаще всего эти заместители находятся в положениях 9, 11 и 15 углеродного скелета родоначальной простановой кислоты. Простагландины разных типов подразделяются на 3 серии в зависимости от числа двойных связей в молекуле. Простагландины 1-й серии имеют одну двойную связь и синтезируются из дигомо-g-линоленовой кислоты с тремя двойными связями, у простагландинов 2-й серии две двойные связи (синтезируются из арахидоновой кислоты с четырьмя двойными связями), а у простагландинов 3-й серии три двойные связи (синтезируются из тимнодоновой кислоты с пятью двойными связями). Номер серии – это нижний цифровой индекс в сокращенном названии простагландинов.
Простагландины (ПГ, PG) – это биологически активные С20-производные гипотетической простановой кислоты. Все многооб-разие типов природных простагландинов зависит от строения и положения кислород-содержащих заместителей: типы простагландинов - А, B, C, D, E, F, G, H, I, J. Чаще всего эти заместители находятся в положениях 9, 11 и 15 углеродного скелета родоначальной простановой кислоты. Простагландины разных типов подразделяются на 3 серии в зависимости от числа двойных связей в молекуле. Простагландины 1-й серии имеют одну двойную связь и синтезируются из дигомо-g-линоленовой кислоты с тремя двойными связями, у простагландинов 2-й серии две двойные связи (синтезируются из арахидоновой кислоты с четырьмя двойными связями), а у простагландинов 3-й серии три двойные связи (синтезируются из тимнодоновой кислоты с пятью двойными связями). Номер серии – это нижний цифровой индекс в сокращенном названии простагландинов.



 Если упростить это уравнение:
Если упростить это уравнение: