
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные р-ции моносахаридов, продукты р-ций и их св-ва
Р-ции полуацетального гидроксила. Уже отмечалось, что моносахариды как в кристаллическом состоянии, так и в растворе в основном существуют в полуацетальных формах. Полуацетальный гидроксил отличается большей р-ционной способностью и может замещаться другими группировками в р-циях со спиртами, карбоновыми к-тами, фенолами и т.д.
Рис. 5.1. α-D-глюкоза. а - линейная формула глюкозы (альдогексоза); б - стр-рная формула по Хеуорсу; в - конформаци-онная формула (форма кресла). Продукт р-ции называют гликозидом. Соотв-енно α- и β-изоме-рам моносахаридов существуют α- и β-глюкозиды. Например, при р-ции метилового спирта с глюкозой (допустим, в β-пиранозной форме) в присутствии неорганических к-т обр-ется продукт алкилирования ме-тил-β-D-глюкопиранозид:
При действии на β-D-глюкопиранозу уксусной к-той обр-ется продукт ацилирования ацетил-β-D-глюкопиранозид:
Ацилированию и метилированию способны подвергаться и остальные группы моносахаридов, но при намного более жестких условиях. Если в р-цию вступают спирты, фенолы или карбоновые к-ты, продукты р-ции называют О-гликозидами. след, метил-β-D-глюкопира-нозид и ацетил-β-D-глюкопиранозид явл О-гликозидами (связь осуществляется через кислород). Природные О-гликозиды, большинство из к-рых обр-ется в результате жизнедеятельности растений, существуют преимущественно в β-форме. Важным классом гликозидов явл N-гликозиды, в к-рых глико-зидная связь осуществляется через азот, а не через кислород. N-гликозиды рассматривают как производные моносахаридов, у к-рых гликозидная часть мол-лы связана через атом азота с радикалом органического соединения R, не являющегося УГом. Как и О-гликозиды, N-гликозиды могут быть построены как пиранозиды или как фуранозиды и иметь α-и β-форму:
К N-гликозидам принадлежат исключительно важные в обмене в-в продукты расщепления нуклеиновых к-т и нуклеопротеидов (нуклеоти-ды и нуклеозиды), АТФ, НАД, НАДФ, нек-рые антибиотики и т.п. (см. главу 3). Р-ции с участием карбонильной группы. Линейная форма в кристаллических препаратах моносахаридов и их растворах присутствует в незначительных количествах, но ее участие в таутомерном равновесии обеспечивает моносахаридам все св-ва, присущие альдегидам (в альдозах) или кетонам (в кетозах). Способность альдоз и кетоз присоединять спирты представлена ранее.
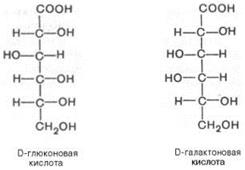
Рассмотрим нек-рые другие их св-ва. Окисление моносахаридов. Обработка альдоз слабыми окислителями приводит к превращению альдегидной группы в положении атома С-1 в карбоксильную группу с обр-нием так называемых альдоновых к-т. Альдоновой к-той может быть D-глюконовая к-та, к-рая обр-ется при окислении альдегидной группы D-глюкозы. Фосфорилированная форма D-глюконовой к-ты играет важную роль в качестве промежуточного продукта УГного обмена. Другой пример – D-галактоновая к-та – продукт окисления альдегидной группы D-га-лактозы.
В альдуроновых, или уроновых, к-тах окислена (с обр-нием карбоксильной группы) первичная спиртовая группа, а альдегидная группа остается неокислен-ной. Уроновая к-та, образующаяся из D-глюкозы, носит название D-глюку-роновой к-ты, а образующаяся из D-галактозы – D-галактоуроновой к-ты. Уроновые к-ты весьма важны в биологическом отношении, многие из них явл компонентами полисахаридов. Восстановление моносахаридов. Моносахариды легко гидрируются по связи С—О и при этом превращаются в многоатомные спирты (сахароспирты). D-глюкоза, например, обр-ет спирт сорбит, а D-манноза – маннит. Восстановление D-фруктозы приводит к эквимол-лярной смеси эпимеров – D-маннита и D-cop-бита, так как в результате гидрирования второй атом углерода становится асимметричным. Такого рода восстановление может осуществляться и ф-тативным путем. Фосфорнокислые эфиры УГов. Моносахариды, этерифицированные фосфорной к-той, играют исключительно большую роль в обмене в-в. Большой интерес представляют пирофосфорные эфиры моносахаридов, например 5-фосфорибозил-1-пирофосфат (ФРПФ), к-рый участвует в синтезе пуриновых и пиримидиновых нуклеотидов. Ниже приводятся формулы нек-рых фосфатов сахаров, играющих важную роль в обмене в-в:
Пептиды Все пептиды делятся на гомомерные и гетеро-мерные. Гомомерные пептиды при гидролизе обр-ют только АМКы, гетеромерные наряду с АМКами соед. др. классов. В зависимости от стр-ры неАМКной компоненты, гетеромерные пептиды делятся на глико-, липо-, нуклео-, фосфопептиды и др. Гомомерные и гетеромерные пептиды могут быть линейными и циклическими. АМКные остатки в них м.б. соединены м/у собой только пептидными связями (гомодетные пептиды) или не только пептидными сложноэфирными, дисульфидными и др. (гете-родетные пептиды). Гетеродетные пептиды с встроенными в цепь гид-роксиАМКами наз. пептолидами. Пептиды, содержащие в мол-ле остатки только одной АМКы, наз. гомо-полиАМКами, а содержащие одинаковые повторяющиеся участки (из одной или неск. АМКных остатков) регулярными пептидами. Особую группу гетеромерных гетеро-детных пептидов обр-ют депсипептиды.
Строение. Пептидная связь имеет св-ва частично двойной связи. Это проявл в уменьшении длины этой связи (0,132 нм)по сравнению с длиной простой связи C N (0,147 нм). Частично двоесвязный хар-р пептидной связи делает невозможным своб. вращение заместителей вокруг нее. поэтому пептидная группировка явл плоской и имеет обычно транс-конфигурацию (ф-ла I). T. обр., остов пептидной цепи представляет собой ряд жестких плоскостей с подвижным ("шарнирным") сочленением в месте, где расположены асимметрич. атомы С (в ф-ле I обозначены звездочкой).
В р-рах пептидов наблюдается предпочтительное обр-ние определенных конформе-ров. С удлинением цепи более выраженную устойчивость приобретают (аналогично белкам) упорядоченные элементы вторичной стр-ры (-спираль и -струк-тура). Обр-ние вторичной стр-ры особенно хар-рно для регулярных пептидов, в частности для полиАМК. Св-ва. Олигопептиды по св-вам близки к АМКам, полипептиды подобны белкам. Олигопептиды представляют собой, как правило, кристаллич. в-ва, разлагающиеся при нагр. до 200 300 0C. Они хорошо раств. в воде, разб. к-тах и щелочах, почти не раств. в орг. р-рителях. Исключение Олигопептиды, построенные из остатков гидрофобных АМК. Олигопептиды обладают амфотерными св-вами и, в зависимости от к-тности среды, могут существовать в форме катионов, анионов или цвиттер-ионов. Осн. полосы поглощения в ИК спектре для группы NH 3300 и 3080 см-1, для группы C=O 1660 см-1. В УФ спектре полоса поглощения пептидной группы находится в области 180-230 нм. Изоэлектрич. точка (рI) пептидов колеблется в широких пределах и зависит от состава АМКных остатков в мол-ле. Величины рКа пептидов составляют для а-СООН ок. 3, для -H2 ок. 8. Хим. св-ва олигопептидов определяются содержащимися в них функц. группами, а также особенностями пептидной связи. Их хим. превращения в значит. мере аналогичны соотв-ующим р-циям АМК. Они дают положит. биуретовую р-цию и нингидриновую р-цию. Дипептиды и их производные (особенно эфиры) легко циклизуются, превращаясь в дикетопиперазины. Под действием 5,7 н. В последние годы значительно повысился интерес к стр-ре и функциям встречающихся в свободном состоянии в орг-ме низкомол-лярных пептидов, выполняющих ряд специфических биологических функций. Короткие пептиды, содержащие до 10 АМК, принято называть олигопептидами; в то же время полипептиды и белки считаются взаимозаменяемыми, хотя термином «полипептиды» чаще обозначают продукты с мол. м. менее 10000. В нек-рых биоактивных пептидах имеются необычные АМКы, не встречающиеся в природных белках, или производные обычных АМК (гормоны, антибиотики). Мнение о том, что пептиды могут играть роль промежуточных продуктов на пути синтеза белка, не подтвердилось, поскольку, как показано в главе 14, этот процесс во всех клетках у всех живых орг-мов осуществляется de novo матричным путем.
Природные пептиды, наделенные биологической активностью, в зависимости от хар-ра действия и происхождения принято делить на 4 группы: 1) пептиды, обладающие гормональной активностью (вазопрессин, окси-тоцин, кортикотропин, глюкагон, кальцитонин, меланоцитстимулирующий гормон, рилизинг-факторы гипоталамуса и др.; см. главу 8); 2) пептиды, принимающие участие в процессе пищеварения (в частности, гастрин и секретин, пептиды, источник к-рых – α2-глобулиновая фракция сыворотки крови (такие, как ангиотензин, брадикинин и каллидин); 4) нейропептиды. В последнее время выяснены нек-рые закономерности синтеза физиологически активных пептидов из биологически инертных предшественников – белков в результате процесса, называемого посттрансляционной модификацией (постсинтетические превращения белковой мол-лы). Известно, например, что ангиотензины (представленные октапептидами), оказывающие выраженное сосудосуживающее действие, обр-ются из присутствующего в сыворотке крови неактивного белка ангиотензиногена в результате послед го действия ряда протеолитических ф-тов (ренина и особого ф-та, участвующего в превращении неактивного ангиотензина I в активный ангиотензин II). К группе вазоактивных (оказывающих влияние на тонус сосудов) пептидов относятся, кроме того, широко применяемые в медицинской практике брадикинин и каллидин. В ткани предсердия ч-ка и жив наз био активные пептиды атриопептидов. Они построены из разного числа АМК (от 23 до 100), но обязательным условием для проявления биологического эффекта явл наличие в мол-ле 17-членной кольцевой стр-ры, образующейся за счет дисуль-фидной связи м/у остатками цистеина. Внутриклеточным посредником действия атриопептидов оказался циклический гуанозинмонофосфат (цГМФ), синтез к-рого осуществляется в результате активирования мембранного ф-та гуанилатциклазы; действие аденилатциклазы, напротив, тормозится под влиянием атриопеп-тидов. Во всех животных тканях и в нек-рых растениях широко распространен низкомол-лярный трипептид глутатион, функции к-рого пока не выяснены достаточно полно, хотя он открыт сравнительно давно. Глута-тион представляет собой атипичный трипептид (в к-ром в обр-нии одной из пептидных связей участвует не α-карбоксильная, а γ-карбок-сильная группа глутамата) следующего строения: γ-глутамил-цистеинил-глицин:
Цистеин явл составной частью глутатиона, поэтому последний может находиться в восстановленной (SH) и в окисленной (S-S) формах (сокращенно обозначаются Г-SH и Г-S-S-Г), что, по-видимому, имеет отношение к биологической роли глутатиона в орг-ме. Интерес к природным пептидам в значительной степени обусловлен необычно высокой их биологической активностью. Они оказывают мощное фармакологическое действие на множество физиологических функций орг-ма. В то же время были замечены низкая стабильность и быстрый распад их в орг-ме при физиологических значениях рН среды. Все это способствовало развитию исследований как в области препаративного выделения природных пептидов из органов и тканей (включая получение биологически активных пептидов из предшественников методами ограниченного протеолиза ряда хорошо известных гормонов), так и в области химического синтеза. Из ткани мозга выделен также δ-пептид сна; ряд других нейропептидов принимает участие в биохимических механизмах памяти, страха, обучения и т.д. Для повышения стабильности пептидов при введении в орг-м предприняты попытки химического синтеза пептидов, в к-рых один или несколько АМКных остатков L-ряда замещают остатками D-АМК. Подобная замена, не вызывая снижения биоактивности, защищает пептид от воздействия протеиназ тканей, способствуя пролонгированию эффекта препарата. Среди естественно встречающихся небольших пептидов следует указать на антибиотик грамицидин S, представляющий собой циклический декапептид: в стр-ре грамицидина S имеются 2 остатка орнитина (Орн), производные АМКы аргинина и 2 остатка неприродных D-изомеров фенилаланина. Стрелки указывают направление синтеза от NН2-групп к СООН-группам каждого остатка, и вследствие цикличности грамицидин S не имеет конца. Широкое применение, особенно в пищевой промышленности, в качестве заменителя сахара получил искусственный (генноинженерный синтез) ди-пептид, состоящий из L-изомеров аспарагиновой к-ты и метилового эфира фенилаланина, названный аспартамом: Аспартам в сотни раз слаще сахара и легко распадается в орг-ме на две свободные АМКы, абсолютно безвредные для орг-ма; поэтому он рекомендован в качестве заменителя сахара больным диабетом. Это пример пептида, наделенного огромным биологическим эффектом. 3.СФИНГОЛИПИДЫ соед. общей ф-лы RCH(OH)CH(NHCOR')CH2OX (R, R'-алкил, алкенил); мол-лы сфинголипидов имеют D-эритро-конфигурацию. Сфинголипиды включают церамиды (X = Н), фосфосфинголипиды [X = P(O)(O-)Y; напр., при Y = O(CH2)2N(CH3)3- сфингомиелины] и глико-сфинголипиды (Х-моно- или олигосахарид). Сфинголипиды широко распространены в природе, в значит. кол-вах присутствуют в клетках НС животных и ч-ка. Накапливаются в мозге, печени, селезенке при липи-дозах (болезни Ниманна - Пика, Тей-Закса, Гоше и др.).
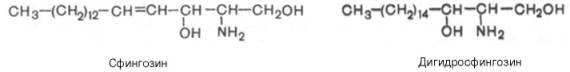
Сфинголипиды облад спос-стью совместно с фосфоглицеридами форм-вать ламеллярные бислойные стр-ры. Устойчивы к слабощелочному и слабокислому гидролизу; при кислом метанолизе сфинголипидов обр-ются гл. обр. RCOOCH3 и сфингозиновые основания RCH(OH)CH(NH2)CH2OH. Среди последних наиб. часто встреч сфинганин, или дигидросфингозин (R = C15H31), 4-сфингенин, или сфингозин (R = С13Н27СН=СН), 4-гидроксисфинганин, или фитосфин-гозин [R = С14Н29СН(ОН)], и их С20-гомологи. Сфинголипиды гидролизуются в кл лизосомальными ф-тами до церамидов и далее под действием цераминидаз расщепляются на высшие к-ты и сфингозиновые основания. Биол. роль сфинголипидов разнообр. Они уч-ют в форм-вании мембранных стр-р аксонов, синапсов и др. кл нервной ткани, опосредуют в орг-ме механизмы узнавания, рецепторные вз-действия, межкл контакты и др. жизненно важные процессы. Сфинголипиды выделяют из разл. прир. источников или синтезируют. Синтез сфинголипидов осуществляется через стадию получения 3-бен-зоилцерамидов RCH(OCOC6H5)CH(NHCOR')CH2OH с последующим использованием р-ций фосфорилирования или гликозилирования. Сфинголипиды применяют в научных исследованиях, особенно широко в виде производных, меченных радиоактивными атомами или флуоресцентными метками, к-рые позволяют тестировать поведение сфинголипидов в тканях, клетках или мембранных стр-рах. Гликосфинголипиды (особенно ганглиозиды) и антитела к ним используют в лечении нек-рых патологич. сост. Сфингомиелины. Это наиболее распростр сфинголипиды. В осн они нах в мембранах жив и растит кл, в нервной ткани. Сфингомиелины обнаружены также в ткани почек, печени и других органов. При гидролизе сфингомиелины обр-ют одну мол-лу ЖК, одну мол-лу двухатомного ненасыщенного спирта сфингозина, одну мол-лу азотистого основания (чаще это холин) и одну мол-лу фосфорной к-ты. Общую формулу сфингомиелинов можно представить так:
Общий план построения мол-лы сфингомиелина в определенном отношении напоминает строение глицерофосфолипидов. Мол-ла сфин-гомиелина содержит как бы полярную «головку», к-рая несет одновременно и положительный (остаток холина), и отрицательный (остаток фосфорной к-ты) заряды, и два неполярных «хвоста» (длинная алифатическая цепь сфингозина и ацильный радикал жирной к-ты). В нек-рых сфингомиелинах, например выделенных из мозга и селезенки, вместо сфингозина найден спирт дигидросфингозин (восстановленный сфингозин):
6. гликолиз и гликогенолиз Распад гликогена (гликогенолиз) Известно, что фосфоролитический распад играет ключевую роль в мобилизации полисахаридов. Фосфорилазы переводят полисахариды (в частности, гликоген) из запасной формы в метаболически активную форму; в присутствии фосфо-рилазы гликоген распадается с обр-нием фосфорного эфира глюкозы (глюкозо-1-фосфата) без предварительного расщепления на более крупные обломки мол-лы полисахарида. В общей форме эту р-цию можно представить в следующем виде: (C6H10O5)n+ H3PO4–> (C6H10O5)n–1+ Глюкозо-1-фосфат, где (С6Н10О5)n означает полисахаридную цепь гликогена, а (С6Н10О5)n,– ту же цепь, но укороченную на один глюкозный остаток. Ф-т фосфорилаза существует в двух формах, одна из к-рых (фосфорилаза а) активна, в то время как другая (фосфорилаза b) обычно неактивна. Обе формы могут диссоциировать на субъединицы. Фосфорилаза b состоит из двух субъединиц, а фосфорилаза а – из четырех. Превращение фосфо-рилазы b в фосфорилазу а осуществляется фосфорилированием белка: 2 Фосфорилаза b + 4 АТФ –> Фосфорилаза а + 4 АДФ. Катализируется эта р-ция ф-том, к-рый называется киназой фосфорилазы b. Установлено, что эта киназа может существовать как в активной, так и в неактивной форме. Неактивная киназа фосфорилазы превращается в активную под влиянием ф-та протеинкиназы (киназа киназы фосфорилазы), и не просто протеинкиназы, а цАМФ-зависимой протеинкиназы. Активная форма последней обр-ется при участии цАМФ, к-рая в свою очередь обр-ется из АТФ под действием ф-та аденилатцик-лазы, стимулируемой, в частности, адреналином и глюкагоном. Увеличение содержания адреналина в крови приводит в этой сложной цепи р-ций к превращению фосфорилазы b в фосфорилазу а и, след, к освобождению глюкозы в виде глюкозо-1-фосфата из запасного полисахарида гликогена. Обратное превращение фосфорилазы а в фосфорилазу b катализируется ф-том фосфатазой (эта р-ция практически необратима). Образовавшийся в результате фосфоролитического распада гликогена глюкозо-1-фосфат превращается под действием фосфоглюкомутазы в глюкозо-6-фосфат. Для осуществления данной р-ции необходима фосфо-рилированная форма фосфоглюкомутазы, т.е. ее активная форма, к-рая обр-ется, как отмечалось, в присутствии глюкозо-1,6-бисфосфата.
Обр-ние свободной глюкозы из глюкозо-6-фосфата в печени происходит под влиянием глюкозо-6-фосфатазы. Данный ф-т катализирует гидролитическое отщепление фосфата:
Жирными стрелками указан путь распада, тонкими - путь синтеза. Цифрами обозначены ф-ты: 1 - фосфорилаза; 2 - фос-фоглюкомутаза; 3 - глюкозо-6-фосфатаза; 4 - гексокиназа (глюкокиназа); 5 - глюко-зо-1-фосфат-уридилтрансфераза; 6 - глико-генсинтаза. Заметим, что фосфорилированная глюкоза в противоположность неэте-рифицированной глюкозе не может легко диффундировать из клеток. Печень содержит гидролитический ф-т глюкозо-6-фосфатазу, к-рый и обеспечивает возм-сть быстрого выхода глюкозы из этого органа. В мышечной ткани глюкозо-6-фосфатаза практически отсутствует. Можно считать, что сохр постоянства конц-ции глюкозы в крови явл результатом одноврем протекания 2 проц: поступления глюкозы в кровь из печени и потребления ее из крови тканями, где она испол-ся как энергетический материал. В тканях (в том числе в печени) распад глюкозы происходит двумя основными путями: анаэробным (при отсутствии кислорода) и аэробным, для осуществления к-рого необходим кислород. №24
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 232; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.201.71 (0.028 с.) |












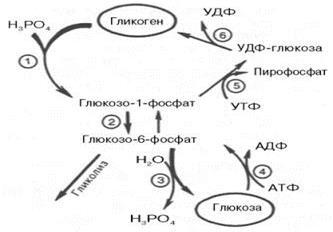 Распад и синтез гликогена (схема).
Распад и синтез гликогена (схема).


