
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Краткая история развития биохимииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте КРАТКАЯ ИСТОРИЯ РАЗВИТИЯ БИОХИМИИ Биохимия – это сравнительно молодая наука, она возникла на рубеже 19 в. Впервые в научной литературе термин «биохимия» использовал в 1903 году немецкий химик Карл Нойберг. Как наука биохимия сформировалась относительно недавно, однако корни ее уходят в глубокую древность. Так на основе биохимических процессов развивались такие производства как сыроварение, хлебопечение, виноделие, выделка кожи и т.д. Необходимость борьбы с болезнями заставляла задумываться о преврщении веществ в организме, искать объяснение целебным свойствам растений. Авиценна (980-1037) – разработал первую химическую классификацию веществ, применяемых в медицине, и изложил ее в труде «Канон врачебной науки». Средние века, период «алхимии» – это попытки создания химическим путем «панацеи» от всех болезней. 16-17 вв. – появилось особое направление «ятрохимия» от греч. «ятрос» – врач). Немецкий врач-ятрохимик Парацельс выдвинул прогрессивное по тем временам предположение о тесной связи химии и медицины. Ван-Гель-Монт высказался о наличии в живых организмах факторов, участвующих в различных химических процессах. 17-18 вв. – немецкий химик и врач Шталь сформулировал теорию горючего начала – теорию «флогистона»: якобы в процессе горения из горючего вещества выделяется особое невесомое вещество – флогистон. Эти метафизические воззрения были опровергнуты работами Ломоносова и Лавуазье, которые открыли законы сохранения массы. Лавуазье показал, что при горении, также как и при дыхании поглощается О2 и выделяется СО2. К концу 18 в. был накоплен большой практический материал и выделено огромное количество органических соединений растительного и животного происхождения. Работы Реомюра и Спалланцони положили начало изучению ферментов пищеварительных соков. 1814 г. – русский ученый Кирхгофф описал осахаривание крахмала под действием фермента амилазы. Либих (1839) выяснил, что главные компоненты животных и растений – это белки, жиры, углеводы. Бертло (1854) – провел синтез жиров; Бутлеров (1861) – синтез углеводов. Накопление большого числа сведений о химическом составе животных и растений, химических превращениях, которые в них происходят, привело к систематизации уже имеющихся данных в учебных руководствах Либиха – в Европе, Ходнева – в России. Повсеместно в медицинских институтах открывались соответствующие кафедры. Таким образом, в конце 19 в., появилась новая отрасль химии – биологическая химия, т.е. химия жизни, химия жизненных процессов. При этом: были заложены главные направления биохимии; открыты основные классы соединений, содержащиеся в живых организмах; были выделены белки из многих животных и растительных организмов; изучение продуктов гидролиза белков привело к открытию аминокислот (АК). Открытие швейцарским ученым Мишером в 1869 г. ДНК привело к изучению нуклеиновых кислот (НК). Были поставлены первые опыты по взаимопревращению жиров, белков, углеводов. Возникло учение о витаминах (Лунин, Эйкман, Функ и другие), о ферментах (Манасеина, Павлов), гормонах (Бернар). В 20 в. биохимия достигла подлинного расцвета: Фишером была обоснована пептидная теория строения белков; Кноопом, Ленинджером – окисление и биосинтез жирных кислот; Кребсом, Мейергофом – созданы схемы биохимических превращений углеводов и образования АТФ. К середине 20-го столетия были заложены серьезные основы к развитию таких направлений как биоэнергетика, генная инженерия, молекулярная биология и др. Достижения биохимии широко применяются в медицине, фармации, народном хозяйстве.
Элементный состав белков В белках содержится до 55% – С; 20-25% – О; 16% – N, а также S, P, Mg и др. Доля азота в отличие от других элементов примерно одинакова и составляет 16% и содержание белка в материале часто определяют по количеству азота (сжигание по Къельдалю). Исключение составляет белки-протамины, которые содержат ~30% N. Mr – относительная молекулярная масса белков. Она очень велика: от ≈ 6000Да до нескольких миллионов Да. Например, Mr инсулина = 5733 Да, а вируса табачной мозаики – 40 млн.Да Мономеры или структурные звенья белков. Их можно определить путем кислотного гидролиза белков. Мономерами белков являются α-АК L-ряда. Соединение АК в полипептидную цепь (ППЦ) происходит посредством ковалентных пептидных связей –CO–NH–. Сложная структурная организация. Некоторые природные, а также искусственно полученные полипептиды могут иметь большую Mr, но отнести их к белкам нельзя. Отличает их от белков уникальный признак, присущий только белкам – денатурация. При действии определенных веществ, так называемых детергентов, происходит потеря белком физико-химических свойств, а главное – биологической активности, при этом пептидные связи не разрываются. Таким образом, белки обладают сложной пространственной организацией. Таковы характерные признаки белков. Форма белковых молекул. В природе белки встречаются как в виде нитей – фибрилл, так и в виде шариков – глобул. Иногда глобулярные и фибриллярные формы встречаются в виде комплексов (в мышечной ткани комплекс актина с миозином; в плазме крови содержится фибрилл белка – фибриноген, а также глобулы белка – альбумины и глобулины). Функции белков. 1. Каталитическая – более 99% ферментов или биологических катализаторов являются белками; например каталаза, аспартат-аминотрансфераза. К 90-м годам 20 в. идентифицировано более 2000 ферментов белковой природы. 2. Питательная (или резервная) – казеин – белок молока, овальбумины – белки яйца. 3. Транспортная – дыхательная функция крови, в частности, перенос О2 осуществляется гемоглобином (Нв) - белком эритроцитов. 4. Защитная – специфические защитные белки-антитела нейтрализуют действие чужеродных белков-антигенов. 5. Сократительная – специфические белки мышечной ткани актин и миозин обеспечивают мышечные сокращения и расслабления, т.е. движение. 6. Структурная – такую функцию выполняют белки – коллаген соединительной ткани, кератин – в волосах, ногтях, коже. 7. Гормональная – регуляция обмена веществ осуществляется за счет гормонов – белков или полипептидов гипофиза, поджелудочной железы.
Цвиттер-ион В зависимости от рН–среды АК могут быть в виде анионов, катионов, нейтральных биполярных ионов или в виде смеси их форм. В сильнокислой среде АК присутствуют в виде катионов (q +)
в сильнощелочной среде – в виде анионов (–q)
Величина рН, при которой в водном растворе преобладает цвиттер-ион, т.е. равновесная концентрация «+» и «–» q аминокислот, а также белков, называется изоэлектрической точкой (pI). При достижении такой рН белок становится неподвижным в электрическом поле и выпадает в осадок, что используется в электрофоретических методах анализа белков и аминокислот. Стереохимия аминокислот. Важным свойством АК является их оптическая активность в водных растворах. Это свойство АК обусловлено наличием в их структуре хирального атома С. Хиральным атомом или хиральным центром называется атом, у которого все связи замещены различными радикалами (R):
Оптически неактивной является только АК глицин, которая не имеет хирального центра. Существуют два вида изомеров – структурные и стереоизомеры. Структурные изомеры – это вещества с одинаковой Mr, но различной последовательностью связывания атомов в молекуле.
Стереоизомеры – это изомеры с одинаковой последовательностью соединения атомов, но с различным их расположением в пространстве.
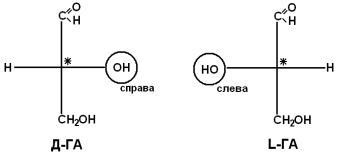
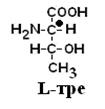
Если 2 стереоизомера относятся друг к другу как предмет и его зеркальное отражение, их называют энантиомерами. Энантиомеры всегда проявляют одинаковые химические и физические свойства за исключением одного – направления вращения плоскости поляризованного луча. Энантиомер, вращающий плоскость поляризации по часовой стрелке, называется правовращающим («+»), а против часовой стрелки – л евовращающим («–»). Природные аминокислоты являются как «+», так и «–». Смесь равного количества молекул правого и левого энантиомеров называется рацемической смесью. Рацематы не обладают оптической активностью. По пространственному расположению атомов и радикалов вокруг хирального центра различают аминокислоты Д– и L–ряда. Для определения принадлежности АК к Д– или L–ряду сравнивают конфигурацию ее хирального центра с энантиомером глицеральдегида (ГА).
По аналогии, в аминокислотах если NH2–группа расположена справа от оси СООН-R, то это Д–АК, а если слева – L–АК.
Все аминокислоты природных белков являются α–АК. Классификация белков В зависимости от химического состава белки делятся на 3 группы: 1) простые (протеины); 2) пептиды; 3) сложные (протеиды). 1. Простые белки построены из аминокислот и при гидролизе распадаются только на аминокислоты. Протамины и гистоны – содержат до 85% аргинина, поэтому имеют выраженные основные свойства. Белок сальмин, полученный из молок семги; клупеин – из молок сельди, скорее относятся к пептидам, т.к. имеют Mr не более 5000 Да. Протамины в основном являются белковой частью нуклеотидов (ДНК). Гистоны сосредоточены главным образом в ядре и представляют белковую часть РНК. Проламины и глютелины – белки растительного происхождения: зеин получают из кукурузы, глютенин - из пшеницы. Содержат до 25% глу, 10-15% про. Альбумины и глобулины – содержатся в сыворотке крови, молоке, яичном белке, мышцах и т.д. Это глобулярные белки, отличающиеся различной растворимостью (альбумины растворяются лучше), по Mr (альбумины имеют молекулярную массу, равную 69000 Да, глобулины - 150000Да). 2. Пептиды – это низкомолекулярные азотсодержащие соединения, состоящие из остатков аминокислот и имеющие молекулярную массу менее 5000 Да. а) с гормональной активностью (АКТГ, окситоцин, вазопрессин и др.); б) участвующие в процессах пищеварения (секретин, гастрин); в) содержащиеся в α2-глобулярной фракции сыворотки крови (брадикинин, ангиотензин); г) нейропептиды (рилизинг-факторы гормонов, например нейрофизины I и II гипоталамуса, способствуют выделению гормонов окситоцина и вазопрессина). 3. Сложные белки или протеиды – состоят из двух частей: белковой и небелковой. Небелковую часть называют простетической группой, а белковую часть, утратившую простетическую группу, называют апобелком.
Подробно рассмотрим группу гемопротеидов – это Hb и его производное миоглобин (белок мышечной ткани), хлорофиллсодержащие белки и ферменты (цитохромы b, С, С1, каталаза, пероксидаза). Все они в качестве простетических групп содержат Fe (или Mg)– порфирины, а отличаются белковой частью.
Структуру гема впервые раскрыл Ненцкий, а его синтез провел Фишер. HbA1 – основной представитель Hb крови взрослого человека; Фетальный HbF – в крови новорожденного содержится до 80%, к концу 1-го года жизни он почти полностью заменяется на HbA1. HbA состоит из 4 ППЦ: 2α–субъединиц и 2b–субъединиц. Четыре субъединицы или протомера ППЦ гемоглобина связаны друг с другом гидрофобными взаимодействиями. Молекула гемоглобина диссоциирует на два димера - ab и a1b1. Каждый протомер содержит гем, находящийся в гидрофобной «нише», защищающей его от окисления в ферри-форму. Mr ППЦ гемоглобина равна 64458 (64500) Да.
В основе простетической группы Нbлежит протопорфирин, у которогоимеются: в положении 1,3,5,8-СН3– метильный R; в положении 2,4 СН2=СН– винильнный R; в положении 6,7 СООН–СН2–СН2 – остатки пропионовой кислоты. Железо, входящее в состав гемоглобина, имеет 2 ковалентные и 4 координационные связи; четыре связи образуют связи с атомами азота, пятая координационная связь присоединяет кислород к гему, шестая – связывает гем и ППЦ.
Определение первичной структуры белка (ПСБ). ПСБ белков можно определить с помощью фенилтиогидантоиновогометода. Этот метод основан на реакции взаимодействия фенилизотиоцианата (ФИТЦ) с α-АК. В результате образуется комплекс этих двух соединений – ФИТЦ -АК. Например, рассмотрим пептид
ФИТЦ взаимодействует с концевой аминокислотой (а). Образуется комплекс ФТГ-а, его отделяют от смеси и определяют подлинность аминокислоты а. Например, это – асн Приоритет в расшифровке ПСБ принадлежит Сенджеру (1953), который открыл ПСБ инсулина (Лауреат Нобелевской премии). Молекула инсулина состоит из 2х ППЦ – A и B.
А-цепь состоит из 21 аминокислоты, цепь В – из 30. Между собой ППЦ соединяются дисульфидными мостиками. Число белков, ПСБ которых определена, к настоящему времени достигает 1500. Даже небольшие изменения первичной структуры могут существенно изменить свойства белка. В эритроцитах здоровых людей содержится HbA – при замене в b-цепи HbA, в 6-м положении глу на вал возникает тяжелейшее заболевание серповидно-клеточная анемия, при которой дети, родившиеся с этой аномалией, погибают в раннем возрасте. С другой стороны, возможны варианты изменения ПСБ, которые не сказываются на его физико-химических и биологических свойствах. Например, HbC содержит в 6-м положении b-цепи вместо глу – лиз, HbС почти не отличается по своим свойствам от HbA, а люди, имеющие в эритроцитах такой Hb, практически здоровы. Стабильность ПСБ обеспечивается в основном прочными ковалентными пептидными связями и, во вторую очередь, дисульфидными связями. Вторичная структура белка (ВСБ). ППЦ белков обладают большой гибкостью и приобретают определенную пространственную структуру или конформацию. В белках различают 2 уровня такой конформации – это ВСБ и третичная структура (ТСБ). ВСБ – это конфигурация ППЦ, то есть способ ее укладки или скручивания в какую-нибудь конформацию, в соответствии с программой, заложенной в П СБ. Известны три основных типа ВСБ: 1) a-спираль; 2) b-структура (складчатый слой или складчатый листок); 3) беспорядочный клубок. a-спираль. Ее модель предложена В. Полингом. Она наиболее вероятна для глобулярных белков. Для любой системы наиболее устойчивым является состояние, соответствующее минимуму свободной энергии. Для пептидов такое состояние имеет место, когда CO– и NH– группы соединяются между собой слабой водородной связью. В a-спирали NH– группы 1-го аминокислотного остатка взаимодействует с CO–группой 4-ой по счету аминокислотой. В результате пептидный остов образует спираль, на каждый виток которой приходится 3,6 АК-остатка.
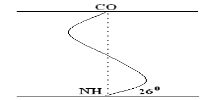
Закручивание ППЦ происходит по часовой стрелке, то есть у спирали – правый ход. Через каждые 5 витков (18 АК; 2,7 нм) конфигурация ППЦ повторяется. Стабилизируется ВСБ в первую очередь водородными связями, и во вторую – пептидными и дисульфидными. Водородные связи в 10-100 раз слабее обычных химических связей; однако за счет их большого количества они обеспечивают определенную жесткость и компактность ВСБ. Боковые R-цепи a-спирали обращены к наружи и расположены по разные стороны от ее оси.
b-структура. Это складчатые участки ППЦ, по форме напоминающие листок, сложенный в гармошку. Слои ППЦ могут быть параллельными, если обе цепи начинаются с N– или С–конца. Если смежные цепи в слое ориентированы противоположными концами N–С и С–N, то они называются антипараллельными.
Образование водородных связей происходит, как и в a-спирали, между CO– и NH– группами.
Содержание a-спирали и b-структуры в разных белках неодинаково. Не вся ППЦ уложена в спирали или складчатые слои.
Беспорядочный клубок Некоторые участки вообще не имеют какой-либо правильной периодической пространственной конфигурации. Их обозначают как беспорядочный клубок, однако такие участки имеют свою фиксированную конформацию, которая определяется аминокислотным составом этого участка, а также ВСБ и ТСБ смежных областей, окружающих беспорядочный клубок. В областях беспорядочного клубка ППЦ могут легко изгибаться и изменять свою конфигурацию, в то время как a-спираль и b-структуры представляют собой довольно жесткие структуры. Встречаемость a-спирали и b-структуры в различных белках.
Третьичная структура белка (ТСБ). По форме своих молекул и особенностям пространственной структуры белки делятся на две группы – глобулярные и фибриллярные белки. Форма глобулярных белков близка к сферической или эллипсоидной, короткая и длинная ось которых может относиться как 1:50. Фибриллы белков более удлиненной формы. Такой белок может образовывать многомолекулярные нитевидные агрегаты – фибриллы. Фибриллярные белки выполняяют в основном опорную функцию. Функции глобулярных белков более разнообразны. ТС глобулярных белков образуется путем дополнительного скручивания ППЦ, содержащей a-спираль, b-структуру и беспорядочные клубки. ТСБ образуется, главным образом за счет взаимодействия R, основную роль при этом играют дисульфидные связи, слабые водородные, ионные связи и особенно гидрофобные. Дисульфидные связи приводят к тому, что удаленные друг от друга области ППЦ сближаются и образуют фиксированные петли. Гидрофобные взаимодействия осуществляются за счет сближения R аминокислот с молекулой воды. Неполярные гидрофобные R, отталкиваясь от водного окружения, как бы втягиваются внутрь белковой молекулы, образуя там так называемые «сухие зоны». А гидрофильные R обращены к наружи образующейся глобулы и ориентированы в сторону воды. Все образующиеся химические связи определены аминокислотным составом и их чередованием в ППЦ. Таким образом, ТСБ – это компактное расположение или упаковка в пространстве одной или нескольких ППЦ в определенном объеме. Все биологические свойства белковой молекулы связаны с сохранностью их ТС, которая называется нативной конфигурацией белка. Глобулярная молекула (глобула) не является абсолютно жесткой структурой. Небольшие изменения конфигурации белковых молекул происходят как внутри самой молекулы (как бы пульсация), так и при взаимодействии с другими молекулами и напоминает изменение формы резинового мяча при надавливании. Гемоглобинозы Биологическая активность белков находится в прямой зависимости от сохранности ПСБ. При замене хотя бы одной аминокислоты могут возникнуть различные патологии. Например, при даже незначительных изменениях в ППЦ Hb возникают аномальные гемоглобинозы. Их около 200. Гемоглобинозы делятся на две основные группы: 1) гемоглобинопатии; 2) талассемии. Гемоглобинопатии – в их основе наследственное изменение структуры какой-либо цепи Hb. Например, серповидно-клеточная анемия (в основном в странах Южной Америки, Африки, Юго-Восточной Азии). Эритроциты в условиях низкого парциального давления принимают форму серпа. HbS после отдачи О2 (Полинг и авт.) превращается в плохо растворимую и выпадает в осадок в виде веретенообразных кристаллов, которые деформируют клетку и приводят к массивному гемолизу. Болезнь протекает остро и дети погибают в раннем возрасте. Причиной данной патологии является мутация в молекуле ДНК, кодирующей синтез b-цепи Hb, где происходит замена только 1-ой аминокислоты – глу на вал в 6-м положении. Ежегодно погибает около 1 млн. человек. Талассемии – в основе – генетическое нарушение синтеза какой либо ППЦ Hb. При нарушении синтеза b-цепи возникают b-талассемии. Наряду с HbА1 обр. до 15% HbА2 и до 60% HbF – происходит гиперплазия и разрушение костного мозга, поражение печени, селезенки, деформация черепа, тяжелая гемолитическая анемия. Эритроциты приобретают форму мишени.
ЛЕКЦИЯ 3 Виды электрофореза а) Изоэлектрическое фокусирование. Разделение происходит на вертикальной колонке в град. как рН, так и напряжения. С помощью специальных носителей амфолитов в колонке устанавливается град. рН от 0 до 14. В колонку помещают смесь веществ, подключаю электроток. Каждый из компонентов движется к той части колонки, где значение рН соответствует его изоэлектрической точке и там останавливается, то есть фокусируется. Достоинство: происходит разделение, очистка и идентификация белков в один прием. У метода высокая разрешительная способность (0,02 pI). б) Изотахофорез – это электрофорез на поддерживающих средах. После включения электротока ионы с самой высокой подвижностью движутся к соответствующему электроду первыми, с самой низкой – последними, обладающие промежуточной подвижностью – располагаются посередине. в) Диск-электрофорез – прибор состоит из двух сосудов с буфером – верхнего и нижнего, соединенных вертикальными трубками, содержащими разнопористый гель. По мере движения ионизированных частиц под действием электротока. Более высокая пористость – в верхней части геля. г) Иммуноэлектрофорез – метод сочетающий электрофорез с иммунодиффузией (для обнаружения антигенов в сложных физиологических смесях). На специальный носитель перпендикулярно друг другу помещают смесь антигенов и смесь антител. При включении электротока они разделяются на индивидуальные вещества и диффундируют на гелевом носителе. В месте встречи антигена с соответствующим антителом происходит специфическая реакция преципитации в форме дуги. Количеств образовавшихся дуг соответствует количеству антигенов. Методы определения Mr белков У большого числа белков химический состав и последовательность аминокислот не установлена (1010–1012 белков), поэтому у таких белков определяют Mr. При этом используются различные методы. а) Седиментационный метод – определение Mr проводят в специальных центрифугах (первая центрифуга была предложена шведским биохимиком Сведбергом), в которых удается создать центробежное ускорение, которое больше в 200 тыс. и более раз ускорения земного притяжения. Mr определяют по V седиментации молекул. По мере перемещения молекул от центра к периферии образуется резкая граница белок-растворитель. Скорость седиментации выражают через константу седиментации (S):
где V – скорость перемещения границы белок-растворитель (см/с); w – угловая скорость ротора (рад/с); i – расстояние от центра ротора до середины ячейки с раствором белков (см). Величина константы седиментации S, которая равна 1´10–13 С условно принята за 1 и называется 1 Сведбергом (S). S для белков лежит в пределах 1-50 S, иногда до 100 S. Mr белков определяется по уравнению Сведберга:
где R – универсальная газовая постоянная; Т – абсолютная температура по Кельвину; S – константа седиментации; Д – коэффициент диффузии; r – плотность растворителя; V – парциальный удельный объем газа. Этот метод дорогостоящий из-за применения аппаратуры. Более просты и дешевы: б) Гель-фильтрация в тонком слое сефадекса.
в) Диск-электрофорез в полиакриламидном слое – также существует зависимость между логарифмом Mr калибровочных белков и длиной их пробега.
Методы определения гомогенности белков Степень чистоты выделенного белка определяется: ü ультрацентрифугированием; ü методом диск - электрофореза; ü различными иммунохимическими методами; ü определением растворимости белка (метод Нортропа) основан на правиле фаз, согласно которому растворимость чистого вещества при данных условиях опыта зависит только от температуры, но не зависит от концентрации вещества в твердой фазе.
ЛЕКЦИЯ 4 НУКЛЕИНОВЫЕ КИСЛОТЫ В 1868 г. швейцарский ученый Ф. Мишер выделил из ядер лейкоцитов вещество, названное им нуклеином (от греч. nucleus – ядро). В 20-м столетии стало известно химическое строение нуклеина – его назвали ДНК. Позднее открыли и РНК. Мишер определил, что нуклеин содержит большое количество Р, нуклеин обладал выраженными кислыми свойствами. К середине 20 в. было обнаружено, что нуклеиновые кислоты в организме находятся в комплексе с белками, то есть в виде нуклеопротеидов и участвуют в передаче наследственных признаков. Состав нуклеиновых кислот
Кроме главных АО, в нуклеиновых кислотах встречаются минорные пуриновые и пиримидиновые АО (гидроксилированные и метилированные) – до 10% всех нуклеотидов – Т-РНК. В ДНК они встречаются реже.
Углеводная часть
Нуклеиновые кислоты (НК) бывают двух типов: ДНК и РНК. Мономерным звеном нуклеиновых кислот являются мононуклеотиды, которые состоят из 3-х компонентов: азотистого основания (АО), углеводной части и остатка фосфорной кислоты.
Дезоксирибоза
Таким образом, звеном нуклеиновых кислот являются мононуклеотиды, состоящие из трех химически связанных компонентов. Соединение АО с сахаром называется нуклеозидом. Он образуется из мононуклеотида путем отщепления Н3РО4 при гидролизе или под воздействием специфических факторов. Соединение этих трех компонентов происходит за счет b-N-гликозидной связи N1- пиримидинового или N9 пуринового азотистого основания с С1¢ атома пентозы и за счет сложноэфирной связи С5¢ атома пентозы и фосфорной кислотой.
Первичная структура нуклеиновых кислот – это порядок, последовательность расположения мононуклеотидов в полинуклеотидные цепи ДНК или РНК, соединенных между собой 3¢5¢-фосфодиэфирной связью.
К сед. Mr число м/н 1) 28-S-р-РНК ~ 1,5 млн. до 4000 2) 18-S-р-РНК ~ 700 тыс. до 2000 3) 5-S-р-РНК ~ 30 тыс. ~ 100 Вторичная структура р-РНК – это спиралевидные участки, соединенные изогнутой одиночной цепью. Третичная структура р-РНК является скелетом рибосомы. Рибосомы – это субклеточные частицы с Ксед. 80S и Mr~1,5 млн. Они состоят из 2 субъединиц – большой (60S) и малой (40S); при снижении концентрации ионов Mg+2 до 0,1 мМоль 80S-частица распадается на субъединицы. Каждая из субъединиц содержит р-РНК и белки. р-РНК выполняет роль каркаса для объединения белков в определенном объеме. м(и)-РНК – образуется в цитоплазме клетки из предшественника – пре-м-РНК. Последняя имеет копии палиндромов ДНК, поэтому ее вторичная структура содержит «шпильки» и линейные участки. При созревании пре-м-РНК «шпильки» отсекаются ферментами и образуется м-РНК. Кодовым элементом м-РНК является триплет нуклеотидов – кодон. Каждый кодон соответствует определенной аминокислоте. Вторичная структура м-РНК – это изогнутая цепь, а третичная – подобна нити, намотанной на катушку, роль которой играет особый транспортный белок – информофер. м-РНК составляет ~ 2-5% всей РНК-клетки. т-РНК – составляет ~ 15% всей РНК клетки, имеется несколько десятков видов т-РНК, отличаются они ПС. Mr т-РНК ~ 25 000 ДА. Находятся в цитоплазме. ВС т-РНК имеет форму «клеверного листа». т-РНК построено из одной полинуклеотидной цепи. Но в этой цепи имеются участки в виде двойной спирали, образованные комплементарными нуклеотидными парами А…V и G…С, они чередуются с неспирализованными участками. Все т-РНК имеют схожую ВС, отличаются ПС. «Клеверный лист» содержит 5 спирализованных стеблей, 4 из которых заканчиваются петлями из неспирализованных нуклеотидов. В центре молекулы находится неспирализованная часть
1. Акцепторный участок – состоит их 4-х линейных нуклеотидов, три из которых имеют одинаковую последовательность ССА. Гидроксил 3′-ОН аденозина свободен. К нему присоединяется СООН-группа аминокислоты. Связанную с 3′-концом аминокислоту т-РНК доставляет к рибосомам, где происходит синтез белка. 2. Антикодоновая петля – образуется 7 нуклеотидами. Содержит специфический для каждой т-РНК триплет нуклеотидов – антикодон. Он по принципу комплементарности спаривается с кодоном м-РНК. Кодон-антикодоновое взаимодействие определяет порядок расположения аминокислот в ППЦ во время ее сборки на рибосоме. 3. Ψ-петля (псевдоуридиловая) – состоит из 7 нуклеотидов и обязательно содержит минорный компонент – остаток псевдоуридиловой кислоты (до 15% минор нуклеотидов). Полагают, что именно этой петлей т-РНК взаимодействует с рибосомой. 4. Д-петля (дигидроуридиловая) – состоит из 8-12 нуклеотидов, в ней всегда соединяются несколько остатков минорного компонента дигидроуридила. Участвует в узнавании аминокислотой своей т-РНК. 5. Во всех т-РНК имеется добавочная петля разной длины и размеров у разных т-РНК. Функции ее мало изучены. Полагают, что с ее помощью уравнивается длина т-РНК. 6. Третичная структура т-РНК – изучена у т-РНКфен и т-РНКасп полученных из дрожжей. Она очень компактна, образуется путем сближения отдельных частей «клеверного листа», имеет форму локтевого сгиба, при этом лепестки петель заворачиваются на тело молекулы, удерживаясь дополнительно Ван-дер-Ваальсовыми силами. Доказано, что т-РНК остаются неизменными вот уже на протяжении 500 млн. лет.
ЛЕКЦИЯ 5 СИНТЕЗ БЕЛКА Сборка полипептидной цепи – это сложный процесс, в котором участвуют:
Процесс синтеза белка называется трансляцией (от английского translation- перевод) т.к. информация, записанная на 4-х буквенном языке НК, переводится на язык белка, состоящий из 20 букв. Этот сложный процесс происходит в субклеточных структурах – рибосомах. Это частицы сферической формы имеющие в диаметре 250 - 350°А и состоит из белка (1/3) и р-РНК 92/3). Рибосомы имеют Ксед 80S и могут диссоциировать в присутствии ионов Mg на большую (60S) и малую (40S) субчастицы. Во всех типах клеток 1-й стадией трансляции является АТФ-зависимое превращение каждой аминокислоты в аминоацил-т-РНК Аминоацил-т-РНКсинтетаза
Этим достигается две цели:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 3296; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.055 с.) |

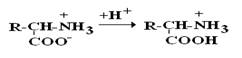
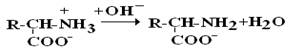
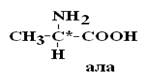
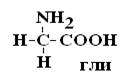
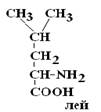
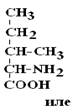
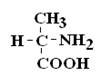
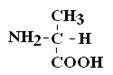
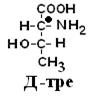

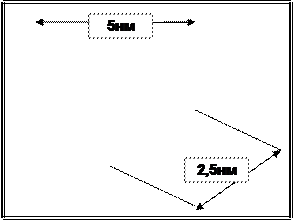


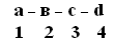 с целью определения его ПСБ, то есть последовательности соединения аминокислотных остатков.
с целью определения его ПСБ, то есть последовательности соединения аминокислотных остатков.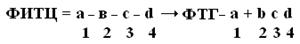
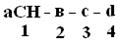 и т.д. Последовательно отделяют и идентифицируют все остальные аминокислоты. Это трудоемкий процесс. Определение ПСБ белка среднего размера занимает несколько месяцев.
и т.д. Последовательно отделяют и идентифицируют все остальные аминокислоты. Это трудоемкий процесс. Определение ПСБ белка среднего размера занимает несколько месяцев.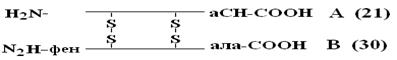

 паралельные
паралельные антипараллельные
антипараллельные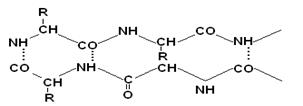

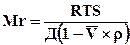










 Состав нуклеиновых кислот
Состав нуклеиновых кислот



 АК + АТФ + т-РНК аминоацил-т-РНК + АМФ + РР(пирофосфат)
АК + АТФ + т-РНК аминоацил-т-РНК + АМФ + РР(пирофосфат)


