Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Структурная организация белков.Содержание книги
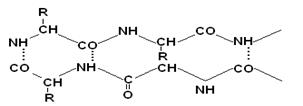
Поиск на нашем сайте Одной из особенностей белков является их сложная структурная организация. Все белки обладают первичной, вторичной и третичной структурой, а те, которые в своем составе имеют две и больше ППЦ обладают и четвертичной структурой (ЧС). Первичная структура белка (ПСБ) – это порядок чередования (последовательность) аминокислотных остатков в ППЦ. Даже одинаковые по своей длине и аминокислотному составу белки могут быть разными веществами. Например, из двух аминокислот можно составить 2 разных дипептида:
При числе аминокислот, равном 20, число возможных комбинаций равно 2´1018. А если учесть, что в ППЦ каждая аминокислота может встретиться больше 1 раза, то число возможных вариантов трудно поддается подсчету. Определение первичной структуры белка (ПСБ). ПСБ белков можно определить с помощью фенилтиогидантоиновогометода. Этот метод основан на реакции взаимодействия фенилизотиоцианата (ФИТЦ) с α-АК. В результате образуется комплекс этих двух соединений – ФИТЦ -АК. Например, рассмотрим пептид
ФИТЦ взаимодействует с концевой аминокислотой (а). Образуется комплекс ФТГ-а, его отделяют от смеси и определяют подлинность аминокислоты а. Например, это – асн Приоритет в расшифровке ПСБ принадлежит Сенджеру (1953), который открыл ПСБ инсулина (Лауреат Нобелевской премии). Молекула инсулина состоит из 2х ППЦ – A и B.
А-цепь состоит из 21 аминокислоты, цепь В – из 30. Между собой ППЦ соединяются дисульфидными мостиками. Число белков, ПСБ которых определена, к настоящему времени достигает 1500. Даже небольшие изменения первичной структуры могут существенно изменить свойства белка. В эритроцитах здоровых людей содержится HbA – при замене в b-цепи HbA, в 6-м положении глу на вал возникает тяжелейшее заболевание серповидно-клеточная анемия, при которой дети, родившиеся с этой аномалией, погибают в раннем возрасте. С другой стороны, возможны варианты изменения ПСБ, которые не сказываются на его физико-химических и биологических свойствах. Например, HbC содержит в 6-м положении b-цепи вместо глу – лиз, HbС почти не отличается по своим свойствам от HbA, а люди, имеющие в эритроцитах такой Hb, практически здоровы. Стабильность ПСБ обеспечивается в основном прочными ковалентными пептидными связями и, во вторую очередь, дисульфидными связями. Вторичная структура белка (ВСБ). ППЦ белков обладают большой гибкостью и приобретают определенную пространственную структуру или конформацию. В белках различают 2 уровня такой конформации – это ВСБ и третичная структура (ТСБ). ВСБ – это конфигурация ППЦ, то есть способ ее укладки или скручивания в какую-нибудь конформацию, в соответствии с программой, заложенной в П СБ. Известны три основных типа ВСБ: 1) a-спираль; 2) b-структура (складчатый слой или складчатый листок); 3) беспорядочный клубок. a-спираль. Ее модель предложена В. Полингом. Она наиболее вероятна для глобулярных белков. Для любой системы наиболее устойчивым является состояние, соответствующее минимуму свободной энергии. Для пептидов такое состояние имеет место, когда CO– и NH– группы соединяются между собой слабой водородной связью. В a-спирали NH– группы 1-го аминокислотного остатка взаимодействует с CO–группой 4-ой по счету аминокислотой. В результате пептидный остов образует спираль, на каждый виток которой приходится 3,6 АК-остатка.
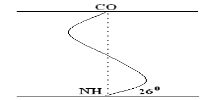
Закручивание ППЦ происходит по часовой стрелке, то есть у спирали – правый ход. Через каждые 5 витков (18 АК; 2,7 нм) конфигурация ППЦ повторяется. Стабилизируется ВСБ в первую очередь водородными связями, и во вторую – пептидными и дисульфидными. Водородные связи в 10-100 раз слабее обычных химических связей; однако за счет их большого количества они обеспечивают определенную жесткость и компактность ВСБ. Боковые R-цепи a-спирали обращены к наружи и расположены по разные стороны от ее оси.
b-структура. Это складчатые участки ППЦ, по форме напоминающие листок, сложенный в гармошку. Слои ППЦ могут быть параллельными, если обе цепи начинаются с N– или С–конца. Если смежные цепи в слое ориентированы противоположными концами N–С и С–N, то они называются антипараллельными.
Образование водородных связей происходит, как и в a-спирали, между CO– и NH– группами.
Содержание a-спирали и b-структуры в разных белках неодинаково. Не вся ППЦ уложена в спирали или складчатые слои.
Беспорядочный клубок Некоторые участки вообще не имеют какой-либо правильной периодической пространственной конфигурации. Их обозначают как беспорядочный клубок, однако такие участки имеют свою фиксированную конформацию, которая определяется аминокислотным составом этого участка, а также ВСБ и ТСБ смежных областей, окружающих беспорядочный клубок. В областях беспорядочного клубка ППЦ могут легко изгибаться и изменять свою конфигурацию, в то время как a-спираль и b-структуры представляют собой довольно жесткие структуры. Встречаемость a-спирали и b-структуры в различных белках.
Третьичная структура белка (ТСБ). По форме своих молекул и особенностям пространственной структуры белки делятся на две группы – глобулярные и фибриллярные белки. Форма глобулярных белков близка к сферической или эллипсоидной, короткая и длинная ось которых может относиться как 1:50. Фибриллы белков более удлиненной формы. Такой белок может образовывать многомолекулярные нитевидные агрегаты – фибриллы. Фибриллярные белки выполняяют в основном опорную функцию. Функции глобулярных белков более разнообразны. ТС глобулярных белков образуется путем дополнительного скручивания ППЦ, содержащей a-спираль, b-структуру и беспорядочные клубки. ТСБ образуется, главным образом за счет взаимодействия R, основную роль при этом играют дисульфидные связи, слабые водородные, ионные связи и особенно гидрофобные. Дисульфидные связи приводят к тому, что удаленные друг от друга области ППЦ сближаются и образуют фиксированные петли. Гидрофобные взаимодействия осуществляются за счет сближения R аминокислот с молекулой воды. Неполярные гидрофобные R, отталкиваясь от водного окружения, как бы втягиваются внутрь белковой молекулы, образуя там так называемые «сухие зоны». А гидрофильные R обращены к наружи образующейся глобулы и ориентированы в сторону воды. Все образующиеся химические связи определены аминокислотным составом и их чередованием в ППЦ. Таким образом, ТСБ – это компактное расположение или упаковка в пространстве одной или нескольких ППЦ в определенном объеме. Все биологические свойства белковой молекулы связаны с сохранностью их ТС, которая называется нативной конфигурацией белка. Глобулярная молекула (глобула) не является абсолютно жесткой структурой. Небольшие изменения конфигурации белковых молекул происходят как внутри самой молекулы (как бы пульсация), так и при взаимодействии с другими молекулами и напоминает изменение формы резинового мяча при надавливании.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 499; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.007 с.) |

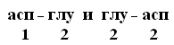
 с целью определения его ПСБ, то есть последовательности соединения аминокислотных остатков.
с целью определения его ПСБ, то есть последовательности соединения аминокислотных остатков.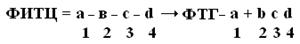
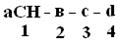 и т.д. Последовательно отделяют и идентифицируют все остальные аминокислоты. Это трудоемкий процесс. Определение ПСБ белка среднего размера занимает несколько месяцев.
и т.д. Последовательно отделяют и идентифицируют все остальные аминокислоты. Это трудоемкий процесс. Определение ПСБ белка среднего размера занимает несколько месяцев.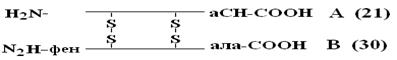

 паралельные
паралельные антипараллельные
антипараллельные