Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Современная рациональная классификация аминокислотСодержание книги
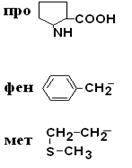
Поиск на нашем сайте в соответствии с ней все аминокислоты делятся на 4 группы. I – Неполярные гидрофобные аминокислоты – их 8.
II –Полярные гидрофильные незаряженные аминокислоты – их 7.
III – Отрицательно заряженные кислые аминокислоты
IV Положительно заряженные основные аминокислоты
Образование пептидных связей. a–СООН группа одной аминокислоты может реагировать с a–NH2 группой другой аминокислоты с образованием пептидных связей.
Пептидные цепи белков – это линейные полимеры a–АК, соединенных пептидной связью. Мономеры аминокислот, входящих в состав полипептидов, называются аминокислотными остатками, цепь повторяющихся групп –NH–CH–CO– называется пептидным остовом. Аминокислотный остаток, имеющий свободную NH2–группу называется N–концевым, а имеющий свободным α–карбоксигруппу – С–концевым. Пептиды пишутся и читаются с N–конца. Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород, вместо него имеется связь с R.
Пептидные связи очень прочные, для их неферментного гидролиза in vitro требуются жесткие условия: высокие t° и r, кислая среда, длительное время. In vivo, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов (E), называемых протеазами или пептидгидролазами. Полипептидная теория строения белков была предложена в 1902 г. Э.Фишером, в ходе дальнейшего развития биохимии эта теория была экспериментально доказана. Экспериментальные доказательства полипептидного 1. Титруются только концевые COOH– и NH2– группы. 2. При гидролизе белков образуется стехеометрическое количество титруемых COOH– и NH2–групп (происходит распад определенного числа пептидных связей). 3. Под действием протеолитических ферментов (протеаз) белки расщепляются на строго определенные фрагменты с концевыми аминокислотами, соответствующими избирательному действию протеаз. 4. Биуретовую реакцию (раствор сульфата меди CuSO4 в щелочной среде – сине-фиолетовое окрашивание) дают и биурет (NH2–CO–NH–CO–NH2), содержащий пептидную связь и белки. 5. Проведенный рентгеноструктурный анализ (разрешительная способность 0,15-0,2 нм) показывает на рентгенограмме пептидную связь. 6. Самое убедительное доказательство – это синтез химическими методами белков с уже расшифрованной структурой. Синтезированные белки обладают физико-химическими свойствами и биологической активностью, аналогичными природным белкам. ЛЕКЦИЯ 2 Классификация белков В зависимости от химического состава белки делятся на 3 группы: 1) простые (протеины); 2) пептиды; 3) сложные (протеиды). 1. Простые белки построены из аминокислот и при гидролизе распадаются только на аминокислоты. Протамины и гистоны – содержат до 85% аргинина, поэтому имеют выраженные основные свойства. Белок сальмин, полученный из молок семги; клупеин – из молок сельди, скорее относятся к пептидам, т.к. имеют Mr не более 5000 Да. Протамины в основном являются белковой частью нуклеотидов (ДНК). Гистоны сосредоточены главным образом в ядре и представляют белковую часть РНК. Проламины и глютелины – белки растительного происхождения: зеин получают из кукурузы, глютенин - из пшеницы. Содержат до 25% глу, 10-15% про. Альбумины и глобулины – содержатся в сыворотке крови, молоке, яичном белке, мышцах и т.д. Это глобулярные белки, отличающиеся различной растворимостью (альбумины растворяются лучше), по Mr (альбумины имеют молекулярную массу, равную 69000 Да, глобулины - 150000Да). 2. Пептиды – это низкомолекулярные азотсодержащие соединения, состоящие из остатков аминокислот и имеющие молекулярную массу менее 5000 Да. а) с гормональной активностью (АКТГ, окситоцин, вазопрессин и др.); б) участвующие в процессах пищеварения (секретин, гастрин); в) содержащиеся в α2-глобулярной фракции сыворотки крови (брадикинин, ангиотензин); г) нейропептиды (рилизинг-факторы гормонов, например нейрофизины I и II гипоталамуса, способствуют выделению гормонов окситоцина и вазопрессина). 3. Сложные белки или протеиды – состоят из двух частей: белковой и небелковой. Небелковую часть называют простетической группой, а белковую часть, утратившую простетическую группу, называют апобелком.
Подробно рассмотрим группу гемопротеидов – это Hb и его производное миоглобин (белок мышечной ткани), хлорофиллсодержащие белки и ферменты (цитохромы b, С, С1, каталаза, пероксидаза). Все они в качестве простетических групп содержат Fe (или Mg)– порфирины, а отличаются белковой частью.
Структуру гема впервые раскрыл Ненцкий, а его синтез провел Фишер. HbA1 – основной представитель Hb крови взрослого человека; Фетальный HbF – в крови новорожденного содержится до 80%, к концу 1-го года жизни он почти полностью заменяется на HbA1. HbA состоит из 4 ППЦ: 2α–субъединиц и 2b–субъединиц. Четыре субъединицы или протомера ППЦ гемоглобина связаны друг с другом гидрофобными взаимодействиями. Молекула гемоглобина диссоциирует на два димера - ab и a1b1. Каждый протомер содержит гем, находящийся в гидрофобной «нише», защищающей его от окисления в ферри-форму. Mr ППЦ гемоглобина равна 64458 (64500) Да.
В основе простетической группы Нbлежит протопорфирин, у которогоимеются: в положении 1,3,5,8-СН3– метильный R; в положении 2,4 СН2=СН– винильнный R; в положении 6,7 СООН–СН2–СН2 – остатки пропионовой кислоты. Железо, входящее в состав гемоглобина, имеет 2 ковалентные и 4 координационные связи; четыре связи образуют связи с атомами азота, пятая координационная связь присоединяет кислород к гему, шестая – связывает гем и ППЦ.
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 601; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.01 с.) |