Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизм фосфорилитического отщепления остатка глюкозы от гликогена.Содержание книги
Поиск на нашем сайте Гликогенфосфорилаза или просто фосфорилаза существует в двух формах: А и В. Форма А более активна, чем В. Оличаются они друг от друга тем, что фосфорилаза А это тетрамер, состоящий из 4-х субъединиц с Мr=360000Да фосфорилаза В – димер, содержащий две субъединицы, его Мr=180000Да. Превращение неактивной формы в активную протекает по схеме:
Под действием адреналина и глюкогона запускается каскад реакций, который заканчивается распадом гликогена. Неактивная киназа фосфорилазы превращается в активную под влиянием фермента цАМФ-зависимой протеинкиназы. Активная форма последней образуется при участии цАМФ, которая в свою очередь образуется из АТФ под действием фермента аденилатциклазы, стимулируемой, в частности, адреналином и глюкагоном. Увеличение содержания адреналина в крови приводит в этой сложной цепи реакций к превращению фосфорилазы В в фосфорилазу А и, следовательно, к освобождению глюкозы в виде глюкозо-1-фосфата из запасного полисахарида гликогена. Обратное превращение фосфорилазы А в фосфорилазу В катализируется ферментом фосфатазой (эта реакция практически необратима). При отсутствии потребности организма в дополнительной глюкозе распад гликогена прекращается.
Каскадный механизм мобилизации и синтеза гликогена
Под действием специфических ферментов происходит инактивирование фосфорилазы А и активирование гликогенсинтазы I, начинается синтез гликогена. Т.о. активирование 1-го фермента каскада – аденилатциклазы приводит к увеличению распада гликогена и подавлению его синтеза.
Гликолиз В клетках человека и других высших организмов образование энергии происходит не только в просе окислительного фосфорилирования (аэробным путем), но и в ходе распада питательных веществ без участия О2 (анаэробным путем). Главным источником получения энергии анаэробным путем служат гексозы, прежде всего α-Д-глюкоза. Гликолиз – это анаэробный распад глк до 2-х молекул молочной кислоты (лактата), протекающих в гиалоплазме клетки.
Суммарное уравнение анаэробного гликолиза
Это экзергонический процесс (выделяется энергия). Освобождающаяся в результате гликолиза энергия аккомулируется в фосфатных связях АТФ. По имени авторов, изучавших этот процесс более проблемно, гликолиз называют путем Элебдена-Мейергофа-Парнаса. Отдельные стадии гликолиза катализируются 11-ю ферментами. Анаэробный гликолиз можно подразделить на две стадии:
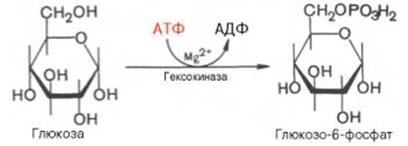
СТАДИЯ 1.↓ Р-ция фосфорилирования глк, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:
Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и практически необратимым процессом. Глк-6-ф в отличии от глк, не проходит через мембрану и как бы «запирается в клетке». Гексокиназа существует в виде четырех изомеров. Первые три преобразуют различные виды гексоз, включая глк. Гексокиназа IV (глюкокиназа) фосфорилирует только глк, имеется в печени, включается в работу при значительных концентрациях глк в крови воротной вены. Остальные изоформы существуют во всех органах и тканях. Гексокиназыа ингибируется глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктом реакции, и аллостерическим ингибитором.
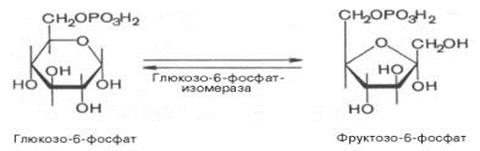
2.↓↑ Превращение (изомеризация) глюкозо-6-фосфата под действием фермента глюкозо- 6-фосфат-изомеразы во фруктозо-6-фосфат:
Эта реакция протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов.
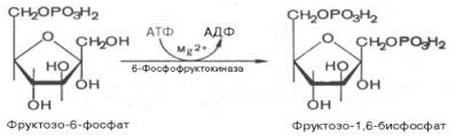
3.↓ Образовавшийся фруктозо-6-фосфат фосфорилируется за счет второй молекулы АТФ:
Данная реакция аналогично гексокиназной практически необратима и является наиболее медленно текущей реакцией гликолиза, так как здесь происходит резкое падение свободной энергии. Фермент фосфофруктокиназа по своей природе аллостерический фермент. Она ингибируется АТФ и стимулируется АМФ. При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.
4.↓↑ Под влиянием фермента альдолаза фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
5.↓↑ Реакция изомеризации триозофосфатов.
Равновесие данной реакции сдвинуто в сторону дигидроксиацетонфосфата. Образуется 95% дигидроксиацетонфосфата и 5% глицеральдегид-3-фосфата. В последующие реакции гликолиза включается только глицеральдегид-3-фосфат. По мере его потребления в ходе дальнейших превращений дигидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
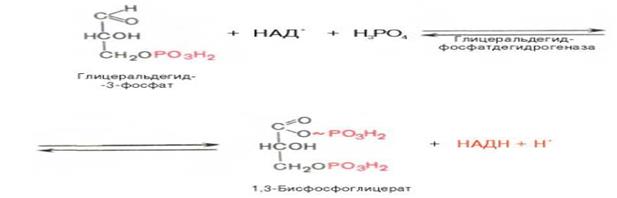
СТАДИЯ 6. ↓↑ Окисление глицеральдегид-3-фосфата в присутствии фермента глицеральдегид-фосфатдегидрогеназы, кофермента НАД и неорганического фосфата (гликолитическая оксидоредукция) с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН).
Реакция обратима, продукты реакции блокируют фермент, поэтому необходимо использовать их непрерывно в ходе реакции. 7. ↓↑ Передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфоглицериновойокислоты (3-фосфоглицерат):
Р-ция экзергоническая, происходит значительное падение свободной энергии, равновесие сдвинуто влево. Реакция обратима – это первая реакция гликолиза где образуется АТФ. В отличие от окислительного фосфорилирования образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
8. ↓↑ Реакция изомеризации. Сопровождается внутримолекулярным переносом оставшейся фосфатной группы. Реакция легкообратима, протекает в присутствии ионов Mg2+.
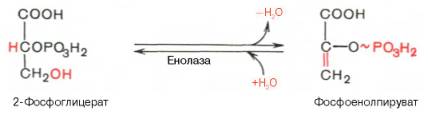
9. ↓↑ Реакция дегидратации. Катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват). В результате образуется еще 1 макроэргическая связь. Реакция обратима.
Енолаза активируется двухвалентными катионами Mg2+ или Мn2+ и ингибируется фторидом.
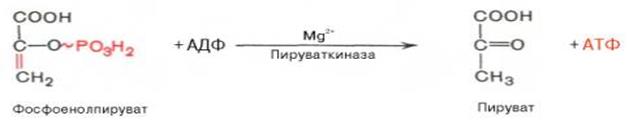
10. ↓ 2-ая реакция гликолитического фосфорилирования. Реакция необратима. Характеризуется резким падением свободной энергии, разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование). Синтезируется еще одна молекула АТФ.
Активируется в присутствии ионов Mg2+, одновалентных катионыов щелочных металлов (К+ или др.). Ингибируется продуктами реакции ПВК и АТФ.
11. Восстановление пировиноградной кислоты до молочной кислотаы. Реакция протекает при участии фермента л актатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции:
Продукт реакции лактат является «тупиком» в обмене веществ, т.к. не вступает ни в один биохимический процесс, кроме обратного превращения в ПВК. При накоплении лактата в клетке нарушается ее рН и останавливается гликолиз.
Т.о. Анаэробный гликолиз – это распад глюкозы до ПВК (с 1-ой до 10 р-ции). При потребности в большем количестве энергии происходит дальнейшее окисление ПВК (ее окислительное декарбоксилирование, преобразование в ацетил-КоА и полное окисление в ЦТК.
Энергетический баланс и биологическая функция гликолиза.
Распад АТФ происходит в 1-ой и 3-ей реакцих, на стадии фосфорилирования глк и фрк. Если учесть, что весь дигидроксиацетон (5-я реакция), превращается в альдегид, то дальше происходят биохимические превращения двух триоз, а значит образование 4-х молекул АТФ в двух стадиях гликолитического фосфорилирования. Т.е. Энергетическая ценность гликолиза – образование двух молекул АТФ на одну молекулу глюкозы.
Три фермента – гексокиназа, фосфофруктокиназа, пируваткиназа (три необратимые реакции) лимитируют скорость гликолиза. Кроме того, контроль гликолиза осуществляется также ЛДГ и ее изоферментами. Воздействуя на них можно регулировать эту скорость. Хотя анаэробный гликолиз дает малый выход энергии (2 молекулы АТФ на 1 мол глк), это единственный процесс в клетках организма, образующий энергию в отсутствии кислорода. Поэтому в кризисных ситуациях (гипоксия) роль анаэробного гликолиза неоценимо велика, т.к. гликолиз протекает во всех клетках и тканях. В этом биологическая роль гликолиза.
|
||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 582; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.24.176 (0.009 с.) |

 2 фосфорилазы В + 4 АТФ акт.киназа фосфорилазы В фосфорилаза А + 4 АДФ
2 фосфорилазы В + 4 АТФ акт.киназа фосфорилазы В фосфорилаза А + 4 АДФ


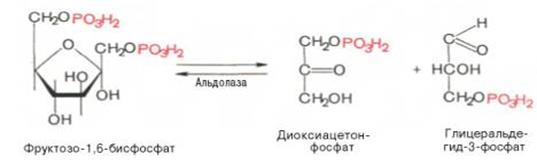 Эта реакция обратима. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидроксиацетонфосфата и глицеральдегид -3-фосфата).
Эта реакция обратима. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидроксиацетонфосфата и глицеральдегид -3-фосфата).