Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Внутрішня енергія. Внутрішня енергія ідеального газу.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Під внутрішньою енергією тіла розуміють суму кінетичної і потенціальної енергії молекул цього тіла. U – це внутрішня енергія. Оскільки в ідеальному газі потенціальна енергія молекул дорівнює нулю (в ідеальному газі молекули не взаємодіють між собою), то внутрішня енергія в ідеальному газі дорівнює тільки сумі кінетичної енергії його молекул. Uід. = Σ Ек Uід. = Ек · N (1) Ек = (3/2) · k · T (2) ν = m/μ; ν = N/Na; m/μ = N/Na; N = (m/μ) · Na; (3) → (1) (2) Uід. = 3/2 · k · T · m/μ Na; K · Na = R
— внутрішня енергія ідеального одноатомного газу.
Робота газу при зміні його об’єму.
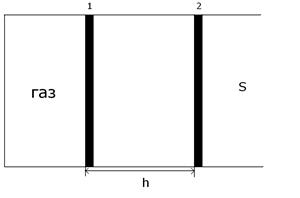
Уявимо заповнений газом циліндр з рухомим поршнем, якщо густина газу в середині циліндра і навколишнього зовнішнього повітря однакова, то поршень не переміщається. Якщо повільно нагрівати газ, то газ почне ізобарвно розширюватися (зовнішній тиск сталий) і поршень переміститься з положення 1 в положення 2 на відстань h. Вважаємо, що поршень переміщається без тертя. Визначимо роботу, яку виконує при цьому газ: A = F · h cos 0 = F · h (1) P = F/S F = p · S (2) (2)→(1) A = p · S · h S · h = ∆V
- робота газу при зміні його об’єму. 1)V1 < V2, ∆V > 0, A > 0 (при розширенні газ виконує доданню роботу); 2)V1 < V2, ∆V = V2 – V1 < 0, A = p · ∆V < 0 (при стисканні газ виконує від‘ємну роботу); 3)V1 = V2, ∆V = V2 – V1 = 0, A = 0 (при ізохорному процесі газ роботи не виконує).
Зміна внутрішньої енергії при нагріванні і охолодженні. Обмін внутрішньої енергії між тілами і навколишнім середовищем або між частинами тіла без виконання механічної роботи називається теплообміном. Зміна внутрішньої енергії при теплообміні дорівнює кількості теплоти. ∆U == Q (при теплообміні)
- кількість теплоти при теплообміні (тобто при нагріванні або охолодженні). c = (Q/m) · ∆T З ф-ли (2) випливає таке означення: питома теплоємність (с) – це фізична величина, яка чисельно дорівнює кількості теплоти, яку потрібно затратити, щоб речовину масою 1 кг нагріти на 1 К. Питома теплоємність залежить від виду речовини (дається в таблицях). [c] = Дж/кг · К Кількість теплоти Q ≥ 0 (завжди), а тому у ф-лі (1) при нагріванні, Т2 > Т1 і ∆Т = Т2 – Т1, а при охолодженні Т2 < Т1 і ∆Т = Т1 – Т2 (виняток).
Рівняння теплового балансу при теплообміні.
- рівняння теплового балансу. Сума кількостей теплоти відданих усіма тілами, в яких внутрішня енергія зменшується, дорівнює сумі кількостей теплоти одержаних усіма тілами в яких внутрішня енергія збільшується (температура збільшується).
Підрахунок теплоти, яка виділяється при спалюванні палива.
- кількість теплоти, яка виділяється при згорянні твердого чи рідкого палива. q – це питома теплота згоряння твердого чи рідкого палива (дається в таблицях). Питома теплота згоряння палива (q) – це фізична величина, яка чисельно дорівнює кількості теплоти, що виділяється при згорянні 1 кг палива. [q] = Дж/кг q = Q/m Q = m · q (1)
- це к-ть теплоти, що виділяється при згорянні газоподібного палива. Vo – це об’єм газу при нормальних умовах. æ = Q/ Vo (4) – питома теплота згоряння газоподібного палива – це фізична величина, яка чисельно дорівнює к-ті теплоти, що виділяється при згорянні 1 !!! газоподібного палива зведеного до нормальних умов. [æ] = Дж/м3 η = Qк · 100 %/Qз η = Aк · 100 %/Aз - ККД
Основи термодинаміки
1.Внутрішня енергія, способи її зміни. 2.Перший закон термодинаміки 3.Застосування першого закону термодинаміки до ізопроцесів в ідеальному газі. 4.Адіабатний процес.
Внутрішня енергія, способи її зміни. В-дь на це питання в посібнику на ст. 37 зверху до „ Називається кількістю теплоти ”.
Перший закон термодинаміки
- перший запис першого закону термодинаміки Зміна внутрішньої енергії системи при її переході з одного стану в інший дорівнює сумі роботи зовнішніх сил, виконаних над системою і кількості теплоти переданої цій системі. Наприклад: ми входимо з морозу у дуже теплу кімнату і трем руки. Руки нагріваються, тобто збільшується їх внутрішня енергія за рахунок виконаної роботи над ними (тертя) і за рахунок передачі теплоти рукам від теплого повітря в кімнаті. У випадку ізольованої системи над нею не виконується робота і вона не обмінюється теплотою з навколишніми тілами, тоді ∆U = U2 – U1 = 0 і звідси випливає, що U2 = U1 – внутрішня енергія ізольованої системи є сталою величиною. А – це робота зовнішніх сил виконаних над системою. А′ - це робота виконана над самою системою. А = - А′ (*) ∆U = A + Q (1) (*) → (1) ∆U = - А′ + Q
- це другий запис першого закону термодинаміки. підведена до системи кількість теплоти частково йде на збільшення внутрішньої енергії системи, а частково на виконання цією системою роботи: згорає паливо під паровим котлом – це тепло, що виділяється йде на збільшення внутрішньої енергії пари (води) і на виконання парою роботи (пара крутить турбіну). Є ще третій запис першого закону термодинаміки: неможливо побудувати вічного двигуна першого роду, тобто машини, яка б не брала нізвідки енергії. Пояснення третього запису першого закону термодинаміки: якщо Q = 0,то з другого запису випливає, що 0 = ∆U + А′ і А′ = -∆U, це значить, що система може виконувати роботу тільки за рахунок зменшення своєї внутрішньої енергії. Цей процес довго продовжуватись не може тому що внутрішня енергія е скінченною величиною.
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 614; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |