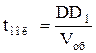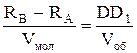Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основи кінетично-молекулярної теоріїСодержание книги
Поиск на нашем сайте
Кінетична і потенціальна енергія молекул. Сили притягання між молекулами діють лиш між різноіменими зарядами молекул, атомів (ядро одного атома притягується до електронів іншого атома), а сили відштовгухування діють між одноіменими зарядами (ядро одного атома відштовхується від ядра іншого). Сили притягання і відштовхування діють тільки на дуже маленьких відстанях, тому прикладаючи один до одного осколки фарфорової чашки не можна її “склеїти”, бо відстань між величезною кількості молекул у щілині така велика, що сили молекулярної взаємодії не виникає, але можна склеїти два свинцевих циліндра, два куски пластиліну (тому, що ці матеріали м’які і плвстичні). Найменша відстань між молекулами, силами притягання і відштовхування можна знехтувати називається радіусом молекулярної дії.
Характеристика газоподібного стану речовини.
Кінетична енергія це інергія руху. Оскільки молекули рухаються, то молекули повині мати кінетичну енергію.
Молекули одного ітого ж газу рухаються з різними швидкостями, а тому вони повині мати різні кінетичні енергії.
Vс.к. – середня квадратична швидкість.
Потенціальна енергія це енергія взаємодії. Оскільки молекули між собою взаємодіють то вони повині мати потенціальну енергію. Немає формули для визначення потенціальної енергії молекул, якщо відстань між молекулами буде більша ніж радіус молекулярної взаємодії, то ця енергія дорівнюватиме 0.
Вимірювання швидкостей руху молекул. Газ не зберігає ні форми, ні об’єму, якщо навколо всіх молекул газу в якийсь момент часу описати радіуси що дорівнюють радіусу молекулярної взаємодії, то більше молекул буде поза сферою дії інших молекул. Отже в газі взаємодіє незначна кількість молекул, вони взаємодіють тільки при зіткненнях. Між зіткненнями молекули в газі рухаються рівномірно і прямолінійно.
Досліди Штерна tмол = tоб
Швидкість молекул водню при температурі 00С дорівнює 1800 м/с, а азоту 500 м/с. Решта в підручнику на ст. 38 "експериментальне визначення молекул" і до кінця цієї ст.
Стала Лошмідта Закон Авогадро – в різних об’ємах різних газів при однакових умовах (температурі і тиску) міститься однакова кількість молекул. Із закону Авогадро випливає, що з об’єму одного моля при однакових умовах має бути однаковим. Vм – це об’єм одного моля газу при нормальних умовах (t=0oC, p≈105 Па) Vм = 22,4*10-3 м3/моль Nл – число Лошмідта це кількість молекул в одиниці об’єму при нормальних умовах.
|
||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 176; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.103.119 (0.008 с.) |


 , mo – маса однієї молекули, V – швидкість однієї молекули.
, mo – маса однієї молекули, V – швидкість однієї молекули.
 ;
;