
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вимірювання температури, температурні шкали.Содержание книги
Поиск на нашем сайте
Фізичний зміст температури. Якщо в графіку з 2 пит. Перенести вісь Ор в ліво, щоб ця вісь переходила через точку А, то ми одержимо графік залежності тиску газу від абсолютної температури.
З школи відомо, що температура визначає ступінь нагрітості тіл, тобто знаючи температуру ми можемо сказати чи тіло гаряче чи тіло холодне. З формули (2) випливає, що Т є мірою середньої кінетичної енергії поступального руху молекул газу. к – стала Больцмана. к=1,38
Основи МКТ газоподібного стану речовини 1. Рівняння Менделєєва-Клаперона. Ідеальний газ.
Рівняння Менделеєва-Клаперона. Ідеальний газ. p=nkT (1)
(2)à (1) pV=nkT (3)
(4)à (3) NA R=8,31 Дж/моль
Об’єднаний газовий закон.
Якщо маса газу не змінюється, то права частина формули (1) також є величиною сталою. З формули (1) випливає, що і ліва частина є сталою величиною якщо маса газу не змінюється.
Процеси у газі які відбуваються при сталій масі називаються ізопроцеси. Об’єднаний газовий закон справджується тільки для ізопроцесів.
Ізопроцеси та їх графіки. 1)Якщо m=const, V=const. Процес у газі який відбувається при сталій масі і незмінному об’ємі називається ізохорним процесом.
При ізохорному процесі тиск газу прямо пропорційний його абсолютній температурі.
Р Р
О Т O V
O T 2)m=const, р=const. Процес у газі при сталій масі і незмінному тиску називається ізобарним процесом.
При ізобарному процесі об’єм газу прямо пропорційний його абсолютній температурі.
3)m=const, Т=const. Процес у газі який відбувається при сталій масі і не змінній температурі називається ізотермічним процесом.
При ізотермічному процесі тиск обернено пропорційний до його об’єму.
Р Р
О V
Друга самостійна робота
Формули по темі МКТ
mo= mв*1,66*10-27 [кг] mo– маса однієї молекули mв– відносна маса (дається в таблиці Менделєєва)
NA– стала Авогадро
m– загальна масса N– кількість молекул
V– об’єм
n– концентрація
Ек –середня кінетична енергія поступального руху молекул газу, k– стала Больцмана Т– температура (вимірюється в Кельвінах).
V– середня квадратична швидкість.
N– кількість молекул
Т=t+273 [К] Т– абсолютна температура t– температура вимірюється в градусах С. Ця формула справджується тільки при н.у. Vм– молярний об’єм.
Ізохорний процес V=const (V1=V2) Ізобарний процес р=const (р1=р2) Ізотермічний процес Т=const (Т1=Т2)
Третя самостійна робота
Основи термодинаміки
1. Внутрішня енергія. Внутрішня енергія ідеального газу. 2. Робота газу при зміні його об’єму. 3. Зміна внутрішньої енергії при нагріванні і охолодженні. 4. Рівняння теплового балансу при теплообміні. 5. Підрахунок теплоти, яка виділяється при спалюванні палива.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 182; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.134.149 (0.009 с.) |


 Решта в посібнику на ст.41 "щоб виміряти температуру" до ст.42 слів "В США користуються шкалою Фаренгейта."
Решта в посібнику на ст.41 "щоб виміряти температуру" до ст.42 слів "В США користуються шкалою Фаренгейта."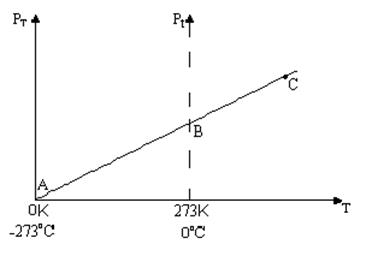 Графік залежності тиску газу від абсолютної температури проходить через початок координат і є прямою лінією. З математики відомо, що ця пряма є прямою пропорційністю (у~х), а тому тиск газу прямо пропорційно залежить від температури. З формули
Графік залежності тиску газу від абсолютної температури проходить через початок координат і є прямою лінією. З математики відомо, що ця пряма є прямою пропорційністю (у~х), а тому тиск газу прямо пропорційно залежить від температури. З формули  випливає, що і середня кінетична енергія поступального руху молекул також залежить прямо пропорційно від температури. Нехай коефіцієнт пропорційності дорівнює
випливає, що і середня кінетична енергія поступального руху молекул також залежить прямо пропорційно від температури. Нехай коефіцієнт пропорційності дорівнює  тоді формула буде мати вигляд
тоді формула буде мати вигляд  .
. 10-23 Дж/К
10-23 Дж/К
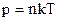
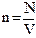 (2)
(2)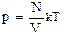

 ;
; 

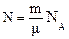

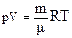 – формула Менделеєва-Клаперона
– формула Менделеєва-Клаперона

 – об’єднаний газовий закон: добуток тиску газу на об’єм розділений на його абсолютну температуру є величина стала, якщо маса газу не змінюється.
– об’єднаний газовий закон: добуток тиску газу на об’єм розділений на його абсолютну температуру є величина стала, якщо маса газу не змінюється.
 (V1=V2)
(V1=V2)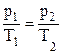 ;
;  – закон Шарля
– закон Шарля



 V
V
 (р1=р2)
(р1=р2)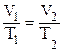 ;
;  – закон Гей-Люсака
– закон Гей-Люсака




 Т
Т
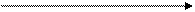 О Р
О Р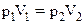 ;
;  – закон Бойля-Маріота
– закон Бойля-Маріота



 Т
Т


 – молярна маса
– молярна маса
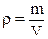
 – густина
– густина

 ,
, = mв*10-3 [кг/моль]
= mв*10-3 [кг/моль] – рівняння Менделєєва-Клапейрона, R– універсальна газова стала (молярна газова стала).
– рівняння Менделєєва-Клапейрона, R– універсальна газова стала (молярна газова стала).



