
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярна фізика і теплота.Содержание книги
Поиск на нашем сайте
Перша самостійна робота
Молекулярна фізика і теплота. 1. Основні положення молекулярно-кінетичного положення і їх підтвердження. 2. Дифузія, броунівський рух. 3. Маса та розміри молекул. 4. Стала Авогадро.
Основні положення молекулярно-кінетичної теорії та їх підтвердження. Молекулою називається найдрібніша частинка речовини, яка здатна самостійно існувати і зберігати хімічні властивості цієї речовини. Основні положення МКТ:
Підтвердження цих положень: 1.Підтвердження першого положення: молекули можна побачити в електронний мікроскоп, сфотографувати в іонний. Те, що між молекулами є проміжки можна довести на такому досліді, а саме при змішувані однієї літри води і спирту ми одержимо менше двох літрів. А це означає, що молекули однієї речовини заходять у молекулярні проміжки другої речовини. 2.Друге положення підтверджується явищами дифузії і броунівського руху. 3.Третє положення підтверджує той факт, що неможливо будь-який предмет стиснути або розтягнути без зусиль.
Дифузія, броунівський рух. n- концентрація ─ це кількість молекул в одиниці об’єму.
Процес вирівнювання концентрації молекул якоїсь речовини в просторі зумовлений хаотичним рухом молекул називається дифузією. Дифузія відбувається найкраще в газах, повільніше в рідинах і дуже повільно в твердих тілах. В твердих тілах дифузія відбувається тому, що відстані між молекулами дуже малі, а сили притягання дуже великі. Дифузія залежить від температури, агрегатного стану, роду речовини.
Рух завислих у рідині або повітрі частинок, що відбувається безперервно, хаотично називається броунівським рухом. Броунівський рух відбувається тому, що в частинку з різних сторін вдаряється різна кількість молекул. Прикладом Бронівського руху є рух пилюки в повітрі, рух маленьких кусочків глини у воді. Броунівський рух залежить від температури, в’язкості, розмірів частинок.
Маса та розміри молекул
Для оцінки розмірів молекул зробимо такий розумовий дослід. Капнемо на поверхню води краплю олії об’ємом V. З часом олія розпливеться і займе площу S. Припустивши, що олія розпливеться до максимальної площі і утворює шар завтовшки одну молекулу, можна визначити діаметр 1 молекули:
Маса молекул 1 а.о.м. називають 1/12 маси атома C12 1 а.о.м. ≈ m (H1) Маса атома (молекули) записана в атомних одиницях маси називається відносною атомною (молекулярною) масою. Відносна маса позначається mв. Відносна маса дається в таблиці Мєндєлєєва. 1 а.о.м. = 1,66*10-27 кг
mo= mв*1,66*10-27 кг – маса молекули в кілограмах.
4. [ mв(He)= 4 а.о.м. mв(H2)= 2 а.о.м. mв(O2)= 32 а.о.м. Одним молем називають таку кількість речовини маса якої в грамах дорівнює відносній молекулярній масі. Маса одного моля називається молярною масою і позначається Молярна маса дорівнює відносній атомній масі 1кг=1000г=103г 1г=10-3 кг
Число Авогадро NA ─ це кількість молекул в одному молі.
Число Авогадро це стала величина.
Досліди Штерна tмол = tоб
Швидкість молекул водню при температурі 00С дорівнює 1800 м/с, а азоту 500 м/с. Решта в підручнику на ст. 38 "експериментальне визначення молекул" і до кінця цієї ст.
Стала Лошмідта Закон Авогадро – в різних об’ємах різних газів при однакових умовах (температурі і тиску) міститься однакова кількість молекул. Із закону Авогадро випливає, що з об’єму одного моля при однакових умовах має бути однаковим. Vм – це об’єм одного моля газу при нормальних умовах (t=0oC, p≈105 Па) Vм = 22,4*10-3 м3/моль Nл – число Лошмідта це кількість молекул в одиниці об’єму при нормальних умовах.
Тиск газу. Поняття вакууму.
pн.а. = 760 мм.рт.ст. ≈ 1,013 pн.а. = 105 Па. Якщо в будь-якому просторі з газом концентрація молекул менша від числа Лошмідта, то вважають, що в цьому просторі є розріджений газ (вакуум). Вважають, що в посудині високий вакуум, якщо довжина вільного пробігу залежить від розмірів посудини.
Фізичний зміст температури. Якщо в графіку з 2 пит. Перенести вісь Ор в ліво, щоб ця вісь переходила через точку А, то ми одержимо графік залежності тиску газу від абсолютної температури.
З школи відомо, що температура визначає ступінь нагрітості тіл, тобто знаючи температуру ми можемо сказати чи тіло гаряче чи тіло холодне. З формули (2) випливає, що Т є мірою середньої кінетичної енергії поступального руху молекул газу. к – стала Больцмана. к=1,38
Об’єднаний газовий закон.
Якщо маса газу не змінюється, то права частина формули (1) також є величиною сталою. З формули (1) випливає, що і ліва частина є сталою величиною якщо маса газу не змінюється.
Процеси у газі які відбуваються при сталій масі називаються ізопроцеси. Об’єднаний газовий закон справджується тільки для ізопроцесів.
Ізопроцеси та їх графіки. 1)Якщо m=const, V=const. Процес у газі який відбувається при сталій масі і незмінному об’ємі називається ізохорним процесом.
При ізохорному процесі тиск газу прямо пропорційний його абсолютній температурі.
Р Р
О Т O V
O T 2)m=const, р=const. Процес у газі при сталій масі і незмінному тиску називається ізобарним процесом.
При ізобарному процесі об’єм газу прямо пропорційний його абсолютній температурі.
3)m=const, Т=const. Процес у газі який відбувається при сталій масі і не змінній температурі називається ізотермічним процесом.
При ізотермічному процесі тиск обернено пропорційний до його об’єму.
Р Р
О V
Друга самостійна робота
Формули по темі МКТ
mo= mв*1,66*10-27 [кг] mo– маса однієї молекули mв– відносна маса (дається в таблиці Менделєєва)
NA– стала Авогадро
m– загальна масса N– кількість молекул
V– об’єм
n– концентрація
Ек –середня кінетична енергія поступального руху молекул газу, k– стала Больцмана Т– температура (вимірюється в Кельвінах).
V– середня квадратична швидкість.
N– кількість молекул
Т=t+273 [К] Т– абсолютна температура t– температура вимірюється в градусах С. Ця формула справджується тільки при н.у. Vм– молярний об’єм.
Ізохорний процес V=const (V1=V2) Ізобарний процес р=const (р1=р2) Ізотермічний процес Т=const (Т1=Т2)
Третя самостійна робота
Основи термодинаміки
1. Внутрішня енергія. Внутрішня енергія ідеального газу. 2. Робота газу при зміні його об’єму. 3. Зміна внутрішньої енергії при нагріванні і охолодженні. 4. Рівняння теплового балансу при теплообміні. 5. Підрахунок теплоти, яка виділяється при спалюванні палива.
Основи термодинаміки
1.Внутрішня енергія, способи її зміни. 2.Перший закон термодинаміки 3.Застосування першого закону термодинаміки до ізопроцесів в ідеальному газі. 4.Адіабатний процес.
Перший закон термодинаміки
- перший запис першого закону термодинаміки Зміна внутрішньої енергії системи при її переході з одного стану в інший дорівнює сумі роботи зовнішніх сил, виконаних над системою і кількості теплоти переданої цій системі. Наприклад: ми входимо з морозу у дуже теплу кімнату і трем руки. Руки нагріваються, тобто збільшується їх внутрішня енергія за рахунок виконаної роботи над ними (тертя) і за рахунок передачі теплоти рукам від теплого повітря в кімнаті. У випадку ізольованої системи над нею не виконується робота і вона не обмінюється теплотою з навколишніми тілами, тоді ∆U = U2 – U1 = 0 і звідси випливає, що U2 = U1 – внутрішня енергія ізольованої системи є сталою величиною. А – це робота зовнішніх сил виконаних над системою. А′ - це робота виконана над самою системою. А = - А′ (*) ∆U = A + Q (1) (*) → (1) ∆U = - А′ + Q
- це другий запис першого закону термодинаміки. підведена до системи кількість теплоти частково йде на збільшення внутрішньої енергії системи, а частково на виконання цією системою роботи: згорає паливо під паровим котлом – це тепло, що виділяється йде на збільшення внутрішньої енергії пари (води) і на виконання парою роботи (пара крутить турбіну). Є ще третій запис першого закону термодинаміки: неможливо побудувати вічного двигуна першого роду, тобто машини, яка б не брала нізвідки енергії. Пояснення третього запису першого закону термодинаміки: якщо Q = 0,то з другого запису випливає, що 0 = ∆U + А′ і А′ = -∆U, це значить, що система може виконувати роботу тільки за рахунок зменшення своєї внутрішньої енергії. Цей процес довго продовжуватись не може тому що внутрішня енергія е скінченною величиною.
Адіабатний процес. Процес, який відбувається без теплообміну з навколишнім середовищем називається адіабатним процесом. При адіабатному процесі Q = 0 і кожний закон термодинаміки буде мати такий вигляд: Q = ∆U + А′ 0 = ∆U + А′ - А′ = ∆U - А′ = A A = ∆U При адіабатному процесі внутрішня енергія системи збільшується тільки за рахунок роботи виконаної над системою. Наприклад:
A = ∆U
Маємо посудину з товстими стінками (погана теплопровідність). Вдаряєм різко по поршню – ефір загоряється попри виконання роботи, внутрішня енергія повітря з парою з ефіром різко збільшується. Цей процес використовується в дизельних двигунах.
Основи термодинаміки ККД теплового двигуна. ККД теплового двигуна. ККД теплового двигуна. Q1 = А′ + Q2 η = Ak /Aз · 100% Ak = A′ = Q1 -Q2 Aз = Q1
- ККД теплового двигуна
- ККД ідеального теплового двигуна. В-дь в підручнику 10 кл. починається на ст. 92 „ККД...” до кінця ст. (на 9 балів), до кінця параграфа (на 12 балів). Звідси 70%.
Випаровування рідини. Насичена і ненасичена пара. Тиск насиченої пари.
Випаровування рідини. Перехід речовини з рідкого стану в газоподібний називається паро утвореним, а з газоподібного в рідкий – конденсацією. Пароутворення, яке відбувається тільки з вільної поверхні рідини, що межує з газопадним середовищем або з вакуумом називається випаровуванням. При випаровуванні з рідини вилітають молекули з найбільшою кінетичною енергією, тому що молекули повинні розірвати зв’язки з іншими молекулами (подолати сили міжмолекулярного притягання). А тому в рідині залишаються молекули з меншою кінетичною енергією. При зменшенні середньої кінетичної енергії молекул, температура рідини зменшується(Eк = (3/2) · k · T), рідина охолоджується (наприклад: виходячи з води – холодно). Навпаки, процес конденсації супроводжується нагріванням (після дощу, якщо не має вітру, стає тепліше). Випаровування залежить від роду рідини (ефір випаровується швидше ніж вода), від температури (чин вища температура, тим інтенсивніше випаровування), від площі поверхні рідини (чим більша площа, тим більше молекул біля молекул біля поверхні), від наявності вітру (вітер відносить молекули пари і сповільнюється конденсація), від зовнішнього тиску.
- к-ть теплоти, яку потрібно затратити, щоб рідину перевести у пару, при сталій температурі. Q – теплота пароутворення. При конденсації виділяється точно така сама кількість теплоти, яка обчислюється за формулою (1). r – питома теплота пароутворення, залежить від роду речовини (дається в таблицях). r = Q/m З ф-ли (2) випливає таке означення: r – це фізична величина, яка чисельно дорівнює кількості теплоти, яку потрібно затратити, щоб рідину масою 1 кг перевести у пару при сталій температурі. При збільшенні температури, r – зменшується.
Насичена і ненасичена пара. В-дь на це питання у посібнику на ст. 5 починається зі слів „Якщо налити рідину” і закінчується на ст. 6 „Таку пару називають ненасиченою”.
Тиск насиченої пари. Тиск насиченої пари (властивості насиченої пари) 1)T = const (ізотермічний процес)
Коли об’єм над рідиною в щільно закритій посудині зменшувати (наприклад переміщати поршень з положення 1 в положення 2), то густина пари збільшується і з газу в рідину переходить більша кількість молекул ніж із рідини в газ. Так триває доти поки знову не встановиться динамічна рівновага і густина пари, і тиск пари не набудуть попереднього значення. А коли об’єм над рідиною, в щільно закритій посудині збільшувати, тобто переміщувати поршень з положення 2 в положення 1, то густина пари і тиск пари в перший момент трохи зменшиться із рідини більше випаровується молекул, щоб зайняти весь об’єм. Коли встановиться динамічна рівновага, то тиск і густина пари будуть мати такі ж самі значення, як і до переміщення поршня. З цього робимо висновок, що тиск насиченої пари від об’єму не залежить. 2)V = const (ізохорний процес) Якщо не змінюючи об’єму, збільшувати температуру в посудині, то можна буде спостерігати, що рівень рідини в посудині зменшуватись, а густина і тиск насиченої пари – збільшується. Якщо температуру зменшувати, то тиск насиченої пари буде також зменшуватись. Висновки: а)тиск насиченої пари залежить тільки від температури і роду речовини; б)закони для ідеального газу до насиченої пари застосовувати не можна; в)чим дальше пара від насичення, тим її властивості більше наближаються до властивостей ідеального газу.
Четверта самостійна робота Кипіння. Вологість повітря.
1. Кипіння 2. Критичний стан речовини 3. Вологість повітря повітря 4. Вимірювання вологості повітря
Кипіння. Пароутворення, яке відбувається в об’ємі всієї рідини при сталій температурі називається кипінням. Температура при якій тиск насиченої пари рідини дорівнює зовнішньому тиску на її поверхню називається температурою кипіння. Відповідь на це питання в підручнику 10 клас на сторінці 55-57.
Критичний стан речовини. Відповідь на це питання в підручнику 10 клас на сторінці 57-58.
Вологість повітря повітря. Величина, яка характеризує вміст водяної пари в повітрі називається вологістю повітря. Ра, rа – абсолютна вологість повітря Ра – тиск тільки однієїводяної пари в повітрі (парціальний тиск) rа – густина водяної пари в повітрі
j = (rа/rн.п.)* 100% (1) j -відносна вологість повітря rн.п -густина насиченої пари при тій самій температурі, що і rа,тобто при температурі повітря Відносна вологість показує ступінь насичення повітря водяною парою. Наприклад, якщо j = 100%, то з формули (1) випливає, що rа = rн.п. В цей момент може йти сніг, град чи дощ.
j = (Ра/Рн.п.) * 100% Рн.п. – тиск насиченої пари при тій самій температурі, що і абсолютний тиск, тобто при температурі повітря.
Рн.п. і rн.п. залежать від температури, даються в спеціальних таблицях. При збільшені температури Рн.п. і rн.п. зростають.
Властивості рідин.
Поверхневий натяг. В рідинах існує ближній порядок у розміщенні молекул, а дальній - відсутній. Рідина являє собою сукупність дуже маленьких, але дуже твердих кристалів протягом часу осілого життя. А тому якщо t=10-10c, то рідина проявляє механічні властивості притаманні твердим тілам: пружність, якщо різко вдарити по воді, то вона може «поламатись»; нестисливість, рідина сама себе стискає тиском 10 тисяч атмосфер. Отже, рідина по своїх властивостях ближче до твердих тіл, ніж до газів.
А = σ∆S σ = А/∆S σ – коефіцієнт поверхневого натягу, залежить від роду рідини і температури, дається в таблицях. Коефцієнт поверхневого натягу – це фізична величина, яка чисельно дорівнює роботі, яку виконують молекулярні сили по скореченню площі вільної поверхні рідини на 1 м2. [σ] = Дж/м2 = Н*м/м2 = Н/м Решта в посібнику на сторінці 78. Сила поверхневого натягу. Рівнодійна молекулярних сил, що діють на молекулу А і напрямлені по поверхні рідини дорівнюють нулю.
напрямлені по поверхні до рідини не дорівнює нулю, а напрямлена до середини поверхні рідини. Ця сила нази- вається силою поверхневого натягу. Сила поверхневого натягу діє на всі молекули рідини, які знаходяться на ме- жі, де рідина граничить з твердим тілом. Сила зумовлена взаємодією молекул рідини, яка спричинює скорочення площі її вільної поверхні називається силою поверхневого натягу. Ця сила напрямлена подотичній довільної поверхні рідини.
A=d*DS DS=2hL A=2dhL A=2Fh 2FS=2dhL Fп=dL Fп – сила поверхневого натягу L – довжина межі вільної поверхні
Завдяки силам поверхневого натягу голка не тане у воді, плавають поводі водомірки.
4.Явища змочування.
Краєвий кут, q, -кут між поверхнею твердого тіла і площиною, що є дотичною до рідини. Для незмочуваних рідин 90° < q £ 180°, а для змочуваних 0° £ q < 90°. Явища капілярності. Капіляр – трубка вузького діаметру. Змочувана рідина пілдіймається доти, доки парціальний тиск не буде рівний тиску стовпа рідини.
Pp=rgh (2) (1)->(2) 2d/R=rgh h=2d/rgh
Властивості твердих тіл
Кристалічні тіла. В моно(один) кристалі всі частинки розміщені упорядковано. В твердих тілах дальній порядок розміщення частинок, а у рідких ближній порядок. Полікристалічне тіло складаєця з багатьох кристалів, але в полікристалічному тілі можна завжди виділити такий маленький об’єкт щоби всі частинки були розміщені упорядковано. В монокристалах властивості мають залежати від напрямку. Властивості: 1) теплопровідність; 2) світлопровідність; 3) механічна міцність; 4) електропровідність. Тобто кристали анізотропні. 2. Аморфні тіла. Наприклад: смола, пластилін, рідке скло. Аморфні речовини зовні тверді але внутрішня будова в них як у рідин. В аморфних речовин нема кристалічної сітки. Понятя про рідкі кристали. Відповідь на сторінці 63. Рідкі кристали – рідини, в яких є порядок розташуння молекул. В рідких кристалах властивості залежать від напрямку тобто вони анізотропні.
Види кристалічних структур. Види кристалічних структур: 1). Молекулярно-кристалічна решітка (лід) – неміцні, низька температура плавлення. 2). Іонна кристалічна решітка (солі) – у вузлах цієї решітки знаходяться позитивні іони металів і негативні іони неметалів; розплави і розчини цих речовин добре проводять електричний струм. 3). Атомна кристалічна решітка (алмази, кремній) – у вузлах цієї решітки знаходяться атоми, які втримуються ковалентним зв¢язком за рахунок спільної електронної пари. 4). Металева кристалічна решітка – у вузлах цієї решітки знаходяться позитивні іони металів, а валентні електрони є вільними і одночасно спільними для всіх іонів. А тому метали дуже добре проводять електричний струм.
∆L – абсолютне видовження
Зміна об’єму або розмірів тіла називається деформацією. Деформація яка зникає після припинення дії сили називається пружною деформацією. Деформація яка залишається після припинення дії сили називається пластичною деформацією.
Якщо тіло деформувати, то говорять, що в тілі виникає механічна напруга. σ = F/S (1) σ – механічна напруга [σ] = H/м2 = Па σ = Еε (2) – закон Гука Закон Гука Механічна напруга, що виникає в пружно деформованому тілі прямо пропорційна відносному видовженню цього тіла Закон Гука справджується тільки для пружніх деформацій. Е – модуль Юнга, залежить від виду речовини, дається в таблицях. Е = σ/ε ;ε = |∆ L| / L0 (3) (1)->(2)<-(3) F/S = E*|∆L| / L0 F = (ES/L0)*|∆L|; ∆L = x; k = ES/L0 F = k|x|
Тверді тіла.
Плавлення і кристалізація. Перехід речовини з твердого стану в рідкий називається плавленням, а з рідкого стану в твердий – кристалізацією (твердненням). Плавлення і тверднення кристалічних речовин відбувається при однаковій температурі, яка не змінюється поки разом існує тверда і рідка фаза речовини. Ця температура називається температурою плавлення. Для того щоб тверде тіло розплавити, потрібно спочатку нагріти його до температури плавлення (затратити кількість теплоти, що йде на нагрівання). Q = cm(T плавлення -T нагрівання ) Потім при температурі плавлення потрібно затратити кількість теплоти, що йде на руйнування кристалічної решітки (на збільшення відстані між молекулами або на руйнування зв’язків між ними). Ця кількість теплоти визначається за формулою Q = λm. При кристалізації виділяється точно така сама кількість теплоти. λ = Q/m λ – питома теплота плавлення, залежить від виду речовини, дається в таблицях. Питома теплота плавлення, λ, - це фізична величина, яка чисельно дорівнює кількості теплоти, яку потрібно затратити, щоб тверде тіло масою 1 кг розплавити при температурі плавлення. [λ] = Дж/кг 4. Зміна об¢єму і густини при плавлені і тверднені. Майже всі речовини при плавлені розшируються, їхній об’єм збільшується, а густина зменшується. Інакше себе поводять такі речовини як лід, германій, кремній, вісмут. Молекули H2O в кристалічній решітці льоду розміщені впритул одна до одної, але при цьому утворюють таку конструкцію в якій є значну порожнини.
На дні не дуже глибоких водойм взимку зберігається температура +4 Со, а тому водойми взимку повністю не промерзають. 5.Теплове розширення тіл. При збільшені температури швидкість руху молекул збільшується, кінетична енергія молекул також збільшується і молекули розходяться на більші відстані. Отже, при збільшені температури всі тіла розширюються. Наприклад, дослід з металічною кулькою і кільцем. L2 = L1(1+α∆t) – формула лінійного розширення твердих тіл L1 – довжина тіла при температурі t1 L2 – довжина тіла при температурі t2 ∆t = t2 - t1 α – коефіцієнт лінійного розширення твердих тіл, залежить від виду речовини, дається в таблицях. V2 = V1(1+β∆t ) – формула об’ємного розширення твердих тіл V1 – об’єм тіла при t1 V2 – об’єм тіла при t2 ∆t = t2 - t1 β – коефіцієнт об’ємного розширення твердих тіл, залежить від речовини, дається в таблицях. β = 3α
П’ята самостійна робота Основи електродинаміки
1. Електризація тіл. 2. Електричний заряд, його дискретність, закон збереження електричного заряду. 3. Закон Кулона. 4. Електричне поле як особливий вид матерії. 5. Напруженість електричного поля. 6. Лінійна пружність електричного поля.
Електризація тіл. Надлишок електричних зарядів одного знаку в якому-небудь тілі називають величиною заряду або кількістю електрики “q”.
[q]= 1A·1c=1Kл
Решта в підручнику на ст. 48.
Закон Кулона. Якщо дія одного тіла на друге або передача інформації від одного тіла до іншого відбувається через матеріальне середовище із скінченною швидкістю, то така дія називається близькодією. Звук поширюється з швидкістю звуку (розмова по телефону). Коли тіла можуть діяти одне на одного через вакуум, то матеріальне середовище, яке пердає цю дію називають полем (поширення світла у вакуумі). Отже, матерія може існувати у вигляді речовини і у вигляді речовини і у вигляді поля. Поле, яке передає дію одного тіла на інше, відповіно до закону Всесвітнього тяжіння, називається полем тяжіння. Поле, яке передає дію одного нерухомого електричного заряду на інший нерухомий заряд, відповідно до закону Кулона називається електричним полем. Швидкість поширення електричного поля – це найбільша швидкість у природі і дорівнює
Властивості електричного поля:
1. Навколо будь-якого електричного заряду існує електричне поле. 2. Поле на поле не діє, поле діє тільки на заряд.
Електричне поле
1. Робота при переміщені заряджених тіл в електричному полі. 2. Потенціальна енергія заряду. 3. Потенціал. Різниця потенціалів і напруга. 4. Звязок між напруженістю і напругою в однорідному електричному полі. Еквівалент потенціальної поверхні. 5. Провідник в електричному полі. 6. Діелек
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 253; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.91.173 (0.014 с.) |


 Броунівський рух.
Броунівський рух.








 – кількість молів, кількість речовини.
– кількість молів, кількість речовини. , означення 1 моля.
, означення 1 моля.
 = mв*10-3 [кг/моль]
= mв*10-3 [кг/моль]
 ;
; 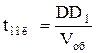


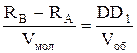



 105 Па = 1атм.
105 Па = 1атм.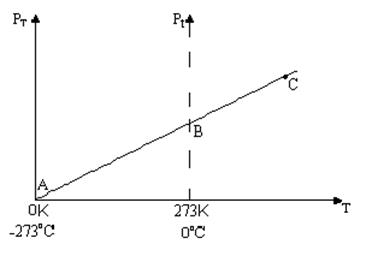 Графік залежності тиску газу від абсолютної температури проходить через початок координат і є прямою лінією. З математики відомо, що ця пряма є прямою пропорційністю (у~х), а тому тиск газу прямо пропорційно залежить від температури. З формули
Графік залежності тиску газу від абсолютної температури проходить через початок координат і є прямою лінією. З математики відомо, що ця пряма є прямою пропорційністю (у~х), а тому тиск газу прямо пропорційно залежить від температури. З формули  випливає, що і середня кінетична енергія поступального руху молекул також залежить прямо пропорційно від температури. Нехай коефіцієнт пропорційності дорівнює
випливає, що і середня кінетична енергія поступального руху молекул також залежить прямо пропорційно від температури. Нехай коефіцієнт пропорційності дорівнює  тоді формула буде мати вигляд
тоді формула буде мати вигляд  .
.
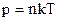


 – об’єднаний газовий закон: добуток тиску газу на об’єм розділений на його абсолютну температуру є величина стала, якщо маса газу не змінюється.
– об’єднаний газовий закон: добуток тиску газу на об’єм розділений на його абсолютну температуру є величина стала, якщо маса газу не змінюється.
 (V1=V2)
(V1=V2)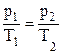 ;
;  – закон Шарля
– закон Шарля



 V
V
 (р1=р2)
(р1=р2)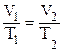 ;
;  – закон Гей-Люсака
– закон Гей-Люсака




 Т
Т
 О Р
О Р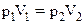 ;
;  – закон Бойля-Маріота
– закон Бойля-Маріота



 Т
Т


 – молярна маса
– молярна маса
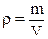
 – густина
– густина

 ,
, – кількість молів або кількість речовини
– кількість молів або кількість речовини – рівняння Менделєєва-Клапейрона, R– універсальна газова стала (молярна газова стала).
– рівняння Менделєєва-Клапейрона, R– універсальна газова стала (молярна газова стала).

 p = nkT
p = nkT
 А – робота, яку виконують молекулярні сили по скороченню площі вільної поверхні рідини на ∆S. Або робота, яку виконують молекулярні сили по втягувані молекул з поверхні рідини в середину.
А – робота, яку виконують молекулярні сили по скороченню площі вільної поверхні рідини на ∆S. Або робота, яку виконують молекулярні сили по втягувані молекул з поверхні рідини в середину. Рівнодійна молекулярних сил, що діють на молекулу В і
Рівнодійна молекулярних сил, що діють на молекулу В і На дротині вигнуті у вигляді букви П, закріпляють рухому поперечину L. Утворюючи таким чином рамку затягують мильною плівкою, занурюючи у мильний розчин. Після мильного розчину поперечина переходить з положення 1 в положення 2. Тобто сили поверхневого натягу виконують роботу по зменшенню вільної поверхні рідини.
На дротині вигнуті у вигляді букви П, закріпляють рухому поперечину L. Утворюючи таким чином рамку затягують мильною плівкою, занурюючи у мильний розчин. Після мильного розчину поперечина переходить з положення 1 в положення 2. Тобто сили поверхневого натягу виконують роботу по зменшенню вільної поверхні рідини.

 Рл=2d/R (1)
Рл=2d/R (1)
 5. Деформація. Види деформації
5. Деформація. Види деформації

 При плавлені відстань між найблищими молекулами H2O – збільшується, але молекули заповнюють внутрішні порожнини, а тому об’єм речовини зменшується, а густини – збільшується. Порожнини зникають при температурі +4 Со і при цій температурі густина води найбільша.
При плавлені відстань між найблищими молекулами H2O – збільшується, але молекули заповнюють внутрішні порожнини, а тому об’єм речовини зменшується, а густини – збільшується. Порожнини зникають при температурі +4 Со і при цій температурі густина води найбільша. Кл
Кл






