
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Критическое состояние веществаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Если изотермически сжимать газ при температуре, меньшей Tкр (изотерма для T = T1), то газ перейдет в двухфазное состояние и затем в жидкое. Газообразное состояние при T < Tкр часто называют паром. Легко видеть, что, если T > Tкр, то, сжимая газ изотермически, его нельзя превратить в жидкость (изотерма для T = T2 ). Это обстоятельство позволило понять, что любой газ можно превратить в жидкость, лишь охладив его до температуры ниже критической и сжимая его. Это предположение впервые высказал Д.И. Менделеев, и он же впервые ввел понятие критической температуры, проводя исследования коэффициента поверхностного натяжения. Учитывая вышесказанное, ученым удалось сжижить все известные газы. При критическом состоянии различие в плотности жидкости и насыщенного пара пропадает. Критическое состояние представляет собой смесь частичек жидкости и пара, которые непрерывно распадаются, превращаясь друг в друга. Вещество при подходе к критической точке мутнеет, так как свет сильно рассеивается на этих неоднородностях среды. Эффект Джоуля-Томсона В реальном газе между молекулами действуют силы притяжения и отталкивания. Силы притяжения обусловлены дипольным взаимодействием молекул. Некоторые молекулы могут представлять собой постоянные диполи. Для неполярных молекул основой притяжения является взаимодействие мгновенных осциллирующих диполей. Силы отталкивания обусловлены взаимодействием электронных оболочек молекул. Они проявляются в основном при сближении молекул и быстро убывают с увеличением расстояния между молекулами. Силы же притяжения наоборот преобладают при большом расстоянии между молекулами. Результирующая сила взаимодействия двух молекул равна сумме этих сил и имеет вид, изображенный на рис. 11.4. При расстоянии между молекулами r = ro сила отталкивания равна силе притяжения и результирующая сила F = 0. При расстоянии между молекулами r < ro преобладает сила отталкивания, при расстоянии r > ro преобладает сила притяжения.
ЛЕКЦИЯ 1 2 §1. Несколько вводных замечаний о предмете физики. §2. Механика 2.2. Кинематика движения материальной точки. Характеристики движения. 2.3. Вектор скорости. Средняя и мгновенная скорость. 2.4. Путь при неравномерном движении. ЛЕКЦИЯ 2 9 2.6. Криволинейное движение. 2.6.1. Ускорение при криволинейном движении (тангенциальное и нормальное ускорение). 2.7. Кинематика вращательного движения. 2.7.1. Угловая скорость. 2.7.2. Угловое ускорение. 2.7.3. Связь между линейной и угловой скоростью. ЛЕКЦИЯ 3 16 §3. Динамика 3.2. II закон Ньютона. 3.3. III закон Ньютона. 3.4. Импульс. Закон сохранения импульса. 3.5. Работа и энергия. ЛЕКЦИЯ 4 234 3.6. Мощность. 3.7. Энергия. 3.8. Кинетическая энергия тела. 3.9. Потенциальное поле сил. Силы консервативные и неконсервативные. 3.10. Потенциальная энергия тела в поле сил тяжести (в поле тяготения Земли). 3.11. Потенциальная энергия в гравитационном поле (в поле всемирного тяготения). 3.12. Потенциальная энергия упруго деформированного тела. ЛЕКЦИЯ 5 300 3.13. Закон сохранения энергии. §4. Механика твердого тела. 4.1. Поступательное движение твердого тела. 4.2. Вращательное движение твердого тела. 4.3. Момент импульса тела. ЛЕКЦИЯ 6 400 4.4. Закон сохранения момента импульса. 4.5. Основное уравнение динамики вращательного движения. 4.6. Кинетическая энергия вращающегося твердого тела. 4.7. Работа внешних сил при вращательном движении твердого тела. ЛЕКЦИЯ 7 45 §5. Гидродинамика 5.1. Линии и трубки тока. 5.2. Уравнение Бернулли. 5.3. Силы внутреннего трения. 5.4. Ламинарное и турбулентное течения. 5.5. Течение жидкости в круглой трубе. 5.6. Движение тел в жидкостях и газах. ЛЕКЦИЯ 8 49 §6. Всемирное тяготение. 6.1. Законы Кеплера. 6.2. Опыт Кавендиша. 6.3. Напряженность гравитационного поля. Потенциал гравитационного поля. ЛЕКЦИЯ 9 53 §7. Основы теории относительности. 7.1. Принцип относительности. 7.2. Постулаты специальной (частной) теории относительности. Преобразования Лоренца 7.3. Следствия из преобразований Лоренца. 7.4. Интервал между событиями. ЛЕКЦИЯ 10 58 §8. Колебания. 8.1. Общие сведения. 8.2. Уравнение гармонического колебательного движения. 8.3. Графическое изображение гармонических колебаний. Векторная диаграмма. 8.4. Скорость, ускорение и энергия колеблющегося тела. ЛЕКЦИЯ 11 634 8.5. Гармонический осциллятор. 8.6. Малые колебания системы вблизи положения равновесия. 8.7. Математический маятник. 8.8. Физический маятник. ЛЕКЦИЯ 12 678 8.9. Затухающие колебания. 8.10. Вынужденные колебания. Резонанс. ЛЕКЦИЯ 13 75 МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА §9. Молекулярная физика 9.1. Предмет и методы молекулярной физики. 9.2. Термодинамическая система. Параметры состояния системы. Равновесное и неравновесное состояние. 9.2.1. Идеальный газ. Параметры состояния идеального газа. 9.2.2. Газовые законы. 9.2.3. Закон Авогадро. 9.2.4. Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона). 9.2. Основное уравнение кинетической теории газов 9.3. Барометрическая формула. Распределение Больцмана ЛЕКЦИЯ 14 91 9.4. Максвелловское распределение молекул по скоростям 9.5. Явления переноса. Длина свободного пробега молекул 9.6. Явление диффузии 9.7. Явление теплопроводности и вязкости ЛЕКЦИЯ 15 97 §10. Термодинамика 10.1. Внутренняя энергия идеального газа 10.2. Работа и теплота. Первое начало термодинамики 10.3. Работа газовых изопроцессов 10.4. Молекулярно-кинетическая теория теплоемкостей 10.5. Адиабатический процесс 10.6. Круговые обратимые процессы. Цикл Карно ЛЕКЦИЯ 16 1044 10.7. Понятие об энтропии. Энтропия идеального газа 10.8. Второе начало термодинамики 10.9. Статистическое толкование второго начала термодинамики ЛЕКЦИЯ 17 1077 §11. Реальные газы 11.1. Уравнение Ван-дер-Ваальса 11.2. Критическое состояние вещества 11.3. Эффект Джоуля-Томсона
|
||||||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 1023; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.008 с.) |

 Рассмотрим семейство опытных изотерм на диаграмме p-V (рис. 11.3), для которых S -образный участок изотермы (11.4) представляет собой прямую линию. Изотерма, проходящая через критическую точку, называется критической. Концы прямолинейных участков семейства изотерм образуют колоколообразную кривую. Колоколообразная кривая и критическая изотерма делят диаграмму p-V на четыре области: жидкость, газ, пар и двухфазную область - жидкость и насыщенный пар (см.рис.11.3).
Рассмотрим семейство опытных изотерм на диаграмме p-V (рис. 11.3), для которых S -образный участок изотермы (11.4) представляет собой прямую линию. Изотерма, проходящая через критическую точку, называется критической. Концы прямолинейных участков семейства изотерм образуют колоколообразную кривую. Колоколообразная кривая и критическая изотерма делят диаграмму p-V на четыре области: жидкость, газ, пар и двухфазную область - жидкость и насыщенный пар (см.рис.11.3).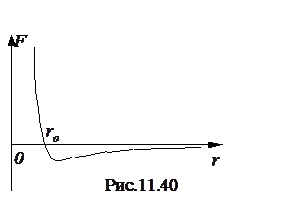
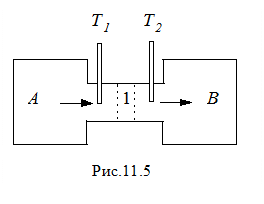 Наличие этих сил проявляется в эффекте дросселирования газа, схема которого представлена на рис.11.5. Газ из сосуда A с высоким давлением перетекает в сосуд B с низким давлением через патрубок с пористой перегородкой 1. В патрубке помещены термометры, измеряющие температуры T1 и T2 газа до и после пористой перегородки. При таком расширении газ работу не совершает, тепло газу не передается и в согласии с первым началом термодинамики изменение внутренней энергии газа D U = 0. Следовательно, при дросселировании идеального газа его температура на должна изменяться: T1 = T2. Внутренняя энергия реального газа складывается из кинетической энергии молекул Uк и потенциальной энергииих взаимодействия Uп,
Наличие этих сил проявляется в эффекте дросселирования газа, схема которого представлена на рис.11.5. Газ из сосуда A с высоким давлением перетекает в сосуд B с низким давлением через патрубок с пористой перегородкой 1. В патрубке помещены термометры, измеряющие температуры T1 и T2 газа до и после пористой перегородки. При таком расширении газ работу не совершает, тепло газу не передается и в согласии с первым началом термодинамики изменение внутренней энергии газа D U = 0. Следовательно, при дросселировании идеального газа его температура на должна изменяться: T1 = T2. Внутренняя энергия реального газа складывается из кинетической энергии молекул Uк и потенциальной энергииих взаимодействия Uп, 


