
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярно-кинетическая теория теплоемкостейСодержание книги
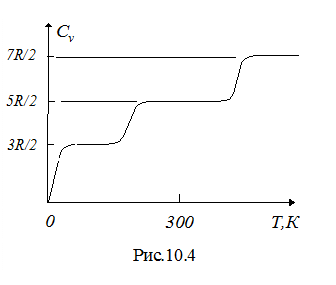
Поиск на нашем сайте Теплоемкостью тела C называют физическую величину, численно равную количеству тепла, которое необходимо сообщить телу для нагревания его на один градус. Если сообщить телу количество тепла dQ, то температура тела повысится на dT градусов и его теплоемкость определится по формуле: C = dQ/dT. (10.8) Размерность теплоемкости равна [ C ] = Дж / К. Теплоемкость моля вещества называется молярной и обозначается символом Cm. Теплоемкость единицы массы называется удельной и обозначается c удили c, причем легко видеть. что Cm = mc уд. Теплоемкость произвольной массы m равна C = c уд m. Отсюда следует, что достаточно знать теплоемкость моля, чтобы рассчитать теплоемкость тела произвольной массы. Согласно первому началу термодинамики dQ = dU + dA. Отсюда следует, что количество тепла dQ, сообщенное телу при повышении его температуры на dT, будет затрачено не только от изменение внутренней энергии dU, но и на работу dA, которую газ при этом совершит. Так как процесс расширения газа на диаграмме p-V можно провести бесчисленным количеством способов, то теплоемкость газа может иметь такое же число значений. Для практических целей наиболее важными являются теплоемкость при постоянном давлении C p и постоянном объеме С v . Рассчитаем теплоемкость моля газа при постоянном объеме C v m. Первое начало термодинамики для изохорного процесса имеет вид dQ = dU m. Выражение (10.8) запишем в виде C v m = dU m /dT. (10.9) Учитывая формулу (10.2), получим C v m = i R /2, (10.10) где i - число степеней свободы движения молекул газа, R - универсальная газовая постоянная. Из выражения (10.10) следует, что теплоемкость C v m моля произвольного газа является постоянной величиной и зависит лишь от числа степеней свободы движения молекул. Следует однако заметить, что выражение (10.10) для воздуха не является справедливым при низких и высоких температурах (рис.10.4). При высоких температурах у молекул возбуждается колебательное движение и часть энергии теплового движения передается колебаниям атомов в молекуле. Число колебательных степеней свободы движения равно 2. При низких температурах, наоборот, наблюдается “замораживание” вращательных степеней свободы движения, объясняемое квантовой механикой. Поэтому зависимость теплоемкости от температуры имеет сложный вид.
C p m = dQ/dT = dU m /dT + dA m /dT, (10.11) где dA m = pdV m - работа моля газа при изменении его объема на dV m; p - давление газа. Учитывая, что pV m = RT, получим dA m = RdT. Если числен-но положить dT = 1, то dA m = R. Отсюда следует, что универсальная газовая постоянная численно равна работе изобарического расширения моля газа при его нагревании на один градус. С помощью формулы (10.9) и выражения для dA m представим равенство (10.11) в виде C p m = C v m + R, (10.12) Выражение (10.12) называется формулой Майера. Величина g = C p /C v представляет собой характерную для каждого газа величину, часто применяющуюся при расчетах. Используя уравнения (10.10) и (10.12), получим g = (i + 2)/i. (10.13) Отсюда для газа из одноатомных молекул (i = 3) получим g = 1,67; для двухтомного газа (i = 5) - g = 1,4; для трехатомного газа (i = 6) - g = 1,33. Адиабатический процесс Наряду с изопроцессами существует адиабатический процесс, широко распространенный в природе. Адиабатическим процессом называют процесс, протекающий без теплообмена с внешней средой. Это означает, что газ при адиабатическом процессе не получает извне тепла: dQ = 0. Первое начало термодинамики для моля газа будет иметь вид dU m = - dA m. С учетом выражений (10.4) и (10.9) запишем последнее равенство в виде C v m dT = -dA m = - pdV m. (10.14) Если при адиабатическом процессе газ расширяется, то dA m Примером адиабатического процесса является распространение звуковых колебаний в воздухе. Сжатия и разряжения воздуха происходят так часто, что тепло не успевает переходить от слоев, имеющих большую температуру, к слоям с меньшей температурой. Следовательно, процессы, происходящие достаточно быстро, близки к адиабатическим. Важное значение адиабатический процесс имеет в объяснении атмосферных явлений. Слои воздуха, поднимающиеся вверх, расширяются, так как атмосферное давление уменьшается с высотой. За счет расширения газ адиабатически охлаждается, поэтому с увеличением высоты температура газа уменьшается. Это объясняет и тот факт, что ветер, дующий с гор, всегда кажется теплым, так как воздух, перемещаясь, сжимается, а ветер, дующий с моря, кажется прохладным. При адиабатическом процессе газ подчиняется уравнению Клапейрона pV m = RT. Наличие дополнительного условия (10.14) позволяет уменьшить в этом уравнении число параметров состояния. Для этого выразим p из уравнения Клапейрона и подставим его в формулу (10.14): C v m dT = - RTdV m /V m. Разделяя переменные, получим dT/T +RdV m /(V m C v m )= 0. Взяв неопределенный интеграл, получим ln T +(R/C v m ) ln Vm = const. В согласии с (10.10) и (10.13) получим (R/C v m ) = 2/i = g - 1 и с учетом последнего выражения ln T +(g - 1) ln V m = const. Потенцируя это равенство, придем к уравнению TVg-1 = const, (10.15) где индекс m опущен. Полученное соотношение представляет собой уравнение адиабаты в переменных T и V. Чтобы от этого уравнения перейти к уравнению с переменными p и V, выразим из уравнения Клапейрона-Менделеева температуру T = mpV/Rm и подставим ее в выражение (10.15). Получим
Соотношение (10.16) называют уравнением Пуассона. По форме это уравнение похоже на уравнение изотермы. Однако при увеличении объема для адиабатического процесса давление падает быстрее, чем для изотермического процесса (рис. 10.5). Согласно выражению (10.14) работа для адиабатического процесса определится по формуле Am = С учетом выражения (10.10) получим для моля газа: A m = (i/2)R(T1 - T2) = (i/2)(p1V1 m - p2V2 m). Для произвольной массы газа m получим A =(i /2)(m /m)(p1V1 - p2V2).
|
||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 365; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.009 с.) |

 Рассмотрим теплоемкость при постоянном давлении для моля газа. Согласно первому началу термодинамики
Рассмотрим теплоемкость при постоянном давлении для моля газа. Согласно первому началу термодинамики 0, dT
0, dT  0, т.е. внутренняя энергия газа уменьшается, температура также уменьшается, газ при адиабатическом расширении охлаждается. При адиабатическом сжатии газа dA m
0, т.е. внутренняя энергия газа уменьшается, температура также уменьшается, газ при адиабатическом расширении охлаждается. При адиабатическом сжатии газа dA m  pVg = const. (10.16)
pVg = const. (10.16) = -
= -  = С m (T1 - T2).
= С m (T1 - T2).


