
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основное уравнение кинетической теории газовСодержание книги
Поиск на нашем сайте Если в предыдущем разделе применялся термодинамический метод исследования, то в этом разделе будет использован статистический метод исследования молекулярных процессов. На основании исследования совокупного действия молекул будут получены такие термодинамические параметры, как давление и температура. Для расчетов воспользуемся моделью идеального газа с точки зрения молекулярно-кинетической теории: 1. молекулы газа непрерывно и хаотично движутся; 2. молекулы взаимодействуют только во время удара; 3. удары молекул абсолютно упругие; 4. размеры молекул малы по сравнению с расстоянием между ними.
При каждом соударении со стенкой молекула передает ей импульс, равный mv1 - (- mv1) = 2 mv1, где m - масса молекулы, v1 -ее скорость. За время Dt молекула пройдет путь v1Dt, соударится со стенкой число раз, равное v1Dt/2l, и передаст стенке импульс DP1 = mv12Dt/l. Просуммируем импульс, переданный стенке всеми n молекулами: DP = (mDt/l)(v12 + v22 +...+ vn2). В данном выражении находится сумма квадратов скоростей. Статистическое усреднение будет заключаться в том, что мы введем новую среднюю величину - среднеквадратичную скорость - по формуле v кв 2 = (v12 + v22 +...+ vn2)/n. Следует заметить, что v кв приблизительно на 10% больше, чем средняя скорость молекулы, которая определяется по формуле: v ср = (v1 + v2 +... + vn)/n. Используя выражение для v кв 2, получим DP = mv кв 2Dtn/l. По второму закону Ньютона на стенку будет действовать сила F = DP/Dt = mv кв 2n/l. Давление газа на стенку найдем по формуле p = F/S = F/l 2 или p = mv кв2 n/l3. Используя формулу (9.8), получим окончательно
Мы получили основное уравнение кинетической теории газов, которое связывает макроскопический параметр - давление газа - с микроскопическими параметрами молекул. Величина no(mv кв 2/2) есть кинетическая энергия молекул, заключенная в единице объема. Отсюда следует, что давление есть мера плотности кинетической энергии молекул. Сравнивая формулы (9.9) и (9.7), получим выражение для средней кинетической энергии молекулы
Итак, мы пришли к важному выводу: кинетическая энергия молекул зависит только от абсолютной температуры. Отсюда следует физический смысл температуры: абсолютная температура есть мера средней энергии поступательного движения молекул. Из формулы (9.10) можно найти среднеквадратичную скорость движения молекул: v кв2 = 3 kT/m = 3RT/m. Для кислорода при комнатной температуре v кв» 480 м/с и сравнима со скоростью пули.
|
||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 371; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.006 с.) |

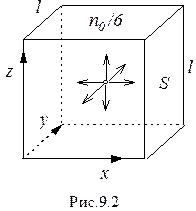 Пусть в сосуде кубической формы объемом V = l 3, где l - длина ребра (рис. 9.2), число молекул в единице объема равно no. Молекулы движутся хаотично и, соударяясь со стенкой площадью S = l 2, оказывают на нее давление. Результаты расчета давления на стенку не изменятся, если хаотическое движение молекул заменить направленным движением их вдоль осей x, y, z. Тогда со стенкой S будет соударяться третья часть от всех молекул, равная
Пусть в сосуде кубической формы объемом V = l 3, где l - длина ребра (рис. 9.2), число молекул в единице объема равно no. Молекулы движутся хаотично и, соударяясь со стенкой площадью S = l 2, оказывают на нее давление. Результаты расчета давления на стенку не изменятся, если хаотическое движение молекул заменить направленным движением их вдоль осей x, y, z. Тогда со стенкой S будет соударяться третья часть от всех молекул, равная (9.8)
(9.8) (9.9)
(9.9) (9.10)
(9.10)


