
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення сталої калориметраСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Порядок виконання роботи 1. В склянку заливають 200 г води. 2. Розраховують кількість KNO3, що припадає на 200 г води, для одержання розчину концентрацією 0,2 - 0,3 Μ. 3. Для визначення маси наважки зважують порожню пробірку, а потім пробірку разом із сіллю з точністю до 0,01 г. 4. Збирають калориметричну установку як показано на рис.1.1. 5. Проводять вимірювання зміни температури у калориметричній системі, яка відбувається внаслідок розчинення солі. При безперервному перемішуванні розчину фіксують зміну температури з точністю до 0,1 °С через кожні 30 с і заносять у робочий зошит. Для визначення точної зміни температури під час досліду процес розчинення умовно поділяють на три періоди: а) Попередній, який триває до 5 хв. б) Головний – процес розчинення солі. в) Заключний – до 5 хвилин.
В головному періоді не припиняють перемішування розчину до повного розчинення солі, фіксуючи зміну температури кожні 30 с. Заключний період прийнято вважати з моменту досягнення рівноваги розчинення солі, тобто з моменту припинення зниження температури (тривалість не менше 5 хв). 6. Зміну температури в системі, яка відбувається внаслідок розчинення солі визначають графічно. Для цього на міліметровому папері, будують графік, де на вісі абсцис відкладають час, а на вісі ординат – температуру. На рис. 1.2 показано одну з можливих діаграм, де FА – попередній період, AD – головний і DС – заключний. Для визначення Δ Τ продовжують (пунктиром) лінію попереднього періоду вправо (ділянка АВ), а лінію заключного періоду вліво (ділянка ОD). Через середину головного періоду (точка К) проводять пряму, паралельну вісі ординат, до перетину з пунктирними лініями. Відстань ОВ дорівнює зміні температури D Τ при розчиненні солі з урахуванням теплообміну між калориметром і навколишнім середовищем. 7. Після розчинення солі за зміною температури розчину в калориметрі визначають кількість теплоти, наданої системі (калориметричний тепловий ефект).
Опрацювання результатів
Калориметричний тепловий ефект розраховують за рівнянням:
де Сp-н – питома теплоємність розчину; mр-н – маса розчину, W – стала калориметра або водяний еквівалент; D Τ – зміна температури розчину в процесі розчинення. Водяний еквівалент калориметра (W) являє собою теплоємність калориметричної системи, тобто кількість теплоти, необхідної для нагрівання або охолодження всіх частин калориметра на один градус:
де Σ m – маса частин калориметра, що беруть участь в теплообміні; cj – питома теплоємність кожної частини калориметра. Отже, водяний еквівалент можна визначити з (1.11) як суму добутків теплоємності кожної з частин калориметра на її мacy крім теплоємності розчину. Сталу калориметра можна визначити за рівнянням (1.10), якщо ввести в калориметр відому кількість теплоти. Калориметричний тепловий ефект для солі KNO3 ( Q KNO3 ) обчислюють за відомою інтегральною теплотою розчинення DH= –35,6 кДж. Калориметричний тепловий ефект для солі KNO3 буде:
Підставивши отримане значення у формулу (1.10) визначають сталу (водяний еквівалент) калориметра за експериментально визначеним значенням Δ ΤКNO3:
де cp – питома теплоємність розчину, яка визначається за питомою теплоємністю води (при 298 К вона становить 4,18 Дж/г×К).
Лабораторна робота № 1.2 ВИЗНАЧЕННЯ ІНТЕГРАЛЬНОЇ ТЕПЛОТИ РОЗЧИНЕННЯ НЕВІДОМОЇ СОЛІ Порядок виконання роботи 1. Після визначення теплового ефекту розчинення солі KNO3 калориметр звільняють від розчину, корки висушують, пробірки витирають тампоном з фільтрувального паперу. 2. В пробірку вносять невідому сіль і зважуванням визначають її масу. 3. Збирають калориметричну установку (рис. 1.1) і, відповідно до п. 5, 6, 7 лабораторної роботи № 1.1 здійснюють процес розчинення невідомої солі, будують графік залежності Τ=f(t), визначають стрибок температури Δ Τ та розраховують калориметричний тепловий ефект за формулою (1.10).
Опрацювання результатів
1. Обчислюють питому теплоту розчинення невідомої солі (теплота розчинення 1 г), Дж/г:
де Q – калориметричний тепловий ефект; mс – маса солі. Перевіряють одержаний результат у викладача, порівнюючи з табличним значенням. 2. Знаючи назву солі і, відповідно, її молярну масу, визначають інтегральну теплоту розчинення цієї солі D Нр, кДж/моль
3. Знайдену інтегральну теплоту розчинення порівнюють з табличним значенням і обчислюють відносну похибку експерименту за формулами (1.16).
Питання для самоперевірки
1. Сформулюйте перший закон термодинаміки та наведіть його аналітичний вираз. 2. Дайте визначення внутрішньої енергії системи. Яка функція називається функцією стану? 3. Сформулюйте закон Гесса. 4. Що називається тепловим ефектом хімічної реакції? 5. В яких випадках застосовують закон Гесса для розрахунку теплових ефектів? 6. Які теплові ефекти виникають під час розчинення солі? 7. Що називається теплотою розчинення речовини? 8. Що розуміють під інтегральною і диференціальною теплотами розчинення речовини? 9. В чому суть калориметричного способу вимірювання теплового ефекту? 10. Що таке стала (водяний еквівалент) калориметра і як її визначають? 11. Чому для визначення DТ необхідно накреслити графік зміни температури з часом? Лабораторна робота № 2
|
||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 1123; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.193.223 (0.01 с.) |

 Рис. 1.2. Графічне визначення температурного перепаду в калориметрі
Рис. 1.2. Графічне визначення температурного перепаду в калориметрі
 (1.10)
(1.10) (1.11)
(1.11)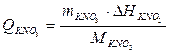 (1.12)
(1.12) (1.13)
(1.13) (1.14)
(1.14) (1.15)
(1.15)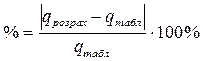 ;
;  (1.16)
(1.16)


