
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аналіз одержаних результатів, висновкиСодержание книги
Поиск на нашем сайте
Сахароза і продукти її гідролізу оптично активні, тобто здатні обертати площину поляризації поляризованого світла: сахароза має праве обертання
Дане рівняння пов’язує концентрацію Оскільки концентрація сахарози прямо пропорційна куту обертання площини поляризації світла, тоді вираз для константи швидкості реакції матиме вигляд:
де
Таблиця 6.1
Знайдене значення константи швидкості реакції К порівнюють з середнім значенням константи швидкості гідролізу сахарози, одержаним аналітично. Загальна похибка експерименту складає:
де Виміри кутів обертання фіксуються за допомогою секундоміру з точністю до 1 с, що дає похибку:
Похибка вимірювання кута обертання за допомогою поляриметра складає
Виходячи з вище сказаного студент робить висновок, що відносна похибка визначення константи швидкості реакції дорівнює 3,1 %. Лабораторна робота №6.2 ВИЗНАЧЕННЯ КОНСТАНТИ ШВИДКОСТІ РОЗЧИНЕННЯ БЕНЗОЙНОЇ КИСЛОТИ У ВОДІ Завдання на виконання роботи 1. Дослідити кінетику розчинення бензойної кислоти у воді шляхом вимірювання зміни концентрації розчину у часі (через 5, 10, 15, 20, 30, 40, 60 хв). 2. Розрахувати константу швидкості реакції аналітичним методом та визначити середнє значення константи швидкості процесу. 3. Побудувати графік в координатах 4. Розрахувати константу швидкості реакції графічним методом, як тангенс кута нахилу прямої.
5. Проаналізувати одержані результати.
Прилади, лабораторний посуд та реактиви
Магнітна мішалка, склянка об’ємом 500 мл, дві конічні колби, бюретка, піпетка на 10 мл, зразок з бензойної кислоти, насичений розчин бензойної кислоти, 0,01 н розчин
Порядок виконання роботи 1. У склянку налити 400 мл дистильованої води і поставити на столик магнітної мішалки. 2. Відрегулювати швидкість перемішування води у склянці (глибина повітряної воронки повинна не перевершувати 5–7 мм). 3. Опустити циліндр бензойної кислоти (закріплений на магнітній мішалці) у воду на глибину, яка дорівнює 1,5–2 см від дна склянки. Відібрати по 10 мл 7 проб розчину бензойної кислоти через такі проміжки часу 5, 10, 15, 20, 30, 40, 60 хв від початку досліду і відтитрувати їх 0,01 нрозчином Таблиця 6.2
4. Відтитрувати 10 мл насиченої кислоти 0,01 н розчином 5. Розрахувати константу швидкості процесу розчинення в різні інтервали часу за рівнянням (6.16). Розрахувати середнє значення константи швидкості реакції. 6. Побудувати графік в координатах 7. Порівняти значення константи швидкості реакції Опрацювання результатів Константу швидкості даної реакції розраховують за формулою:
де За даними табл. 6.2 будують графік у координатах У загальну похибку проведення експерименту входить:
Вимірювання часу при відборі проби кислоти проводили за допомогою секундоміра з точністю до 1 с.
Відбирання проби за допомогою піпетки об’ємом 10 мл складає:
Похибка при титруванні проби кислоти лугом за допомогою бюретки складає:
Отже, загальну похибку проведення експерименту можна прийняти рівною 3,5 %. Питання для самоперевірки 1. Що розуміють під швидкістю хімічної реакції? 2. Сформулюйте закон дії мас. 3. Що таке кінетичне рівняння реакції? 4. У чому полягає фізичний зміст константи швидкості реакції? 5. Поняття про молекулярність реакції. 6. Що називається порядком хімічної реакції? Як визначити порядок складної хімічної реакції? 7. Які реакції називають псевдомолекулярними? 8. Напишіть рівняння реакції гідролізу сахарози. Які продукти реакції отримують? 9. Поясніть, чому реакція гідролізу сахарози відноситься до реакцій першого порядку. 10. Які речовини називаються каталізаторами? Поняття про гомогенний каталіз. До якого виду каталізу відноситься реакція гідролізу сахарози? 11. Як впливає температура на реакцію гідролізу сахарози? 12. Що називається енергією активації? Як її визначити? 13. Чому бімолекулярна реакція розчинення бензойної кислоти у воді відноситься до реакцій першого порядку? 14. Охарактеризувати стадії розчинення бензойної кислоти у воді та вказати лімітуючу стадію. Лабораторна робота № 7
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 398; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.95.120 (0.009 с.) |

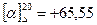 , глюкоза також праве
, глюкоза також праве  , фруктоза має ліве обертання
, фруктоза має ліве обертання  . Кут обертання еквімолекулярної суміші дорівнює алгебраїчній сумі кутів обертання глюкози і фруктози
. Кут обертання еквімолекулярної суміші дорівнює алгебраїчній сумі кутів обертання глюкози і фруктози  . Тому в ході реакції відбувається зменшення кута обертання площини поляризації світла реакційною сумішшю. Реакція проходить в присутності каталізатора – розчину соляної кислоти. Концентрацію розчину можна розрахувати за рівнянням:
. Тому в ході реакції відбувається зменшення кута обертання площини поляризації світла реакційною сумішшю. Реакція проходить в присутності каталізатора – розчину соляної кислоти. Концентрацію розчину можна розрахувати за рівнянням: ( 6.16)
( 6.16)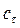 (г/100 мл) оптично активної речовини в розчині, обертання площини поляризації поляризованого світла (питоме обертання
(г/100 мл) оптично активної речовини в розчині, обертання площини поляризації поляризованого світла (питоме обертання  ) і довжину l (дм) поляриметричної трубки (товщина шару розчину).
) і довжину l (дм) поляриметричної трубки (товщина шару розчину). ( 6.17)
( 6.17) – кут обертання на момент початку реакції; ατ – кут обертання на момент часу
– кут обертання на момент початку реакції; ατ – кут обертання на момент часу 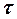 ;
;  – кут обертання, що відповідає закінченню реакції.
– кут обертання, що відповідає закінченню реакції.




 ,
, – похибка вимірювання часу;
– похибка вимірювання часу;  – похибка вимірювання кута обертання.
– похибка вимірювання кута обертання. .
. . Отже, загальна похибка буде дорівнювати:
. Отже, загальна похибка буде дорівнювати: .
. .
. , фенолфталеїн.
, фенолфталеїн.



 і розрахувати константу швидкості реакції графічним методом.
і розрахувати константу швидкості реакції графічним методом.
 , (6.18)
, (6.18) – час відбирання проби від початку досліду, с; а – об’єм 0,01 н розчину
– час відбирання проби від початку досліду, с; а – об’єм 0,01 н розчину 
 .
. .
. .
.


