
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Залежність граничного ступеня набухання желатину від рН розчинуСодержание книги
Поиск на нашем сайте
2. Будують криву залежності граничного ступеня набухання від рН. Ізотерма набухання в ізоелектричній точці проходить через мінімум. Проводять дотичні до початкової та кінцевої ділянок графіка. Перпендикуляр, опущений на вісь абсцис з точки перетину двох дотичних кривої набухання, вказує ізоелектричну точку рН желатину (рНіт) (рис. 12.2).
Питання для самоперевірки
1. Які речовини належать до високомолекулярних? Природні та синтетичні ВМС, приклади. 2. Які особливості будови молекул ВМС? 3. Які властивості розчинів ВМС притаманні істинним, а які колоїдним розчинам? Які специфічні властивості розчинів ВМС? 4. Що таке набухання? Обмежене та необмежене набухання, приклади. 5. Що називається ступенем набухання? Як його можна розрахувати? 6. Охарактеризуйте 4 стадії набухання. 7. Запишіть рівняння швидкості набухання. Графічний метод знаходження граничного ступеня набухання та константи швидкості набухання. 8. Що таке граничний ступінь набухання? Як його можна визначити? 9. Ваговий методи визначення ступеня набухання. 10. Як розраховують швидкість набухання? 11. Які чинники впливають на набухання ВМС? 12. Охарактеризувати вплив на набухання ВМС природи полімера та розчинника, в’язкості розчинника, молекулярної маси ВМС. 13. Як впливає температура на швидкість та ступінь набухання? 14. Як впливає рН середовища на набухання ВМС? 15. Що таке ізоелектричний стан білка? Як визначити ізоелектричну точку желатину за ступенем набухання? 16. Що називається висолюванням? Його вплив на набухання ВМС. Навести ряд Гофмейстера для аніонів та катіонів. 17. Охарактеризувати вплив додавання спирту в розчин на ступінь набухання желатину.
Лабораторна робота № 13 ВИЗНАЧЕНЯ ЗВ`ЯЗАНОЇ ВОДИ ІНДИКАТОРНИМ РЕФРАКТОМЕТРИЧНИМ МЕТОДОМ Мета роботи – ознайомлення з методикою визначення кількості води, що зв`язується гідрофільними ВМС.
Теоретичні відомості
Зв`язаною вважається вода, розташована на межі поділу фаз і приєднана до макромолекул ВМС за механізмом водневого зв’язку. Гідрофільними називають ВМС, що утворюють водневий зв`язок з водою. З усіх видів міжмолекулярної взаємодії Н-зв`язок є найміцнішим і його енергія досягає 20–30 кДж/моль води. Тому властивості води, зв`язаної ВМС, відрізняються від властивостей вільної води. Властивості колоїдних систем в значній мірі залежать від вмісту в ньому зв’язаної та вільної води, тобто від наявних форм зв’язку води з полімерами. Вода має різні види зв’язку із високомолекулярними речовинами: від самого міцного, обумовленого молекулярними силами, до чисто механічного утримання вологи на поверхні дисперсних частинок. Зв’язана вода має наступні відмінні властивості. Вона замерзає при більш низьких температурах, які можуть досягати –15¸–20 0С. Густина і в’язкість зв’язаної води більші, ніж у вільної води, а діелектрична проникність – менша. Зв’язана вода не може бути розчинником для інших речовин. Особливою властивістю зв’язаної води є її дуже слабка рухливість, що обумовлює здатність набухлих білкових драглів зберігати форму. Кількість зв’язаної води визначається гідрофільністю ВМС. Гідрофільність – це кількість зв’язаної води, що припадає на 100г абсолютно сухої речовини ВМС. Чим вища спорідненість макромолекули ВМС до води, тим вища їх гідрофільність і тим більше зв’язаної води містить ВМС. Так, в желатині кількість зв’язаної води у два рази вище маси сухої речовини, а в агар-агарі – в чотири рази. Методи визначення кількості зв`язаної води базуються на використанні її властивостей. Зв`язану воду визначають за теплотою змочування ВМС, за густиною зв`язаної води, за діелектричною проникністю, за зниженням температури замерзання, за властивістю зв’язаної води не бути розчинником для інших речовин. Найбільш розповсюдженим методом визначення зв’язаної води є індикаторно-рефрактометричний. Суть цього методу полягає в тому, що вода, зв`язана гідрофільними ВМС, не є розчинником для інших речовин. Якщо в розчин цукрози концентрацією С0 внести наважку сухого крохмалю, концентрація розчину підвищиться до концентрації Ср внаслідок вибіркової адсорбції крохмалю до води. Отже, розчин цукрози показує (індукує) на цю вибірковість. Речовину – ”індикатор” підбирають таким чином, щоб вона слабко взаємодіяла з ВМС. Початкову і рівноважну концентрації “індикатора” цукру визначають рефрактометром. Якщо в наважці повітряно-сухого крохмалю m з вологістю А % міститься вода в кількості
Мірою гідрофільності називають кількість зв’язаної води, що припадає на одиницю маси абсолютно сухої речовини. Якщо маса сухої речовини, г, n у взятій наважці
то гідрофільність W, виражена у відсотках до наважки сухої речовини,
Завдання на виконання роботи
1. Приготувати розчин сахарози концентрацією, вказаною викладачем і уточнити її на рефрактометрі. 2. Виміряти концентрацію розчину сахарози після його контакту з крохмалем. 3. Розрахувати гідрофільність крохмалю.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 464; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.231.122 (0.009 с.) |

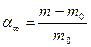
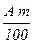 , г, то у разі занурення наважки в розчин цукрози відбувається додаткове зволоження крохмалю. Маса води, що її вбирає наважка крохмалю з розчину індикатора, становить
, г, то у разі занурення наважки в розчин цукрози відбувається додаткове зволоження крохмалю. Маса води, що її вбирає наважка крохмалю з розчину індикатора, становить 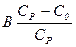 , г, де В – маса розчину цукрози, доданої до наважки крохмалю. Загальна кількість води х, зв`язаної наважкою крохмалю,
, г, де В – маса розчину цукрози, доданої до наважки крохмалю. Загальна кількість води х, зв`язаної наважкою крохмалю,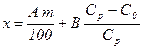 . (13.1)
. (13.1) , (13.2)
, (13.2) (13.3)
(13.3)


